Abstrakt
Zónová elektroforéza je dělící metoda využívající
rozdílů pohyblivosti částic při vloženém konstantním napětí a konstantním
složení základního elektrolytu. Rychlost pohybu částic je přímo úměrná intenzitě
pole a vloženému potenciálu, nepřímo závisí na viskozitě prostředí.
Související informace
Text
Zónová elektroforéza
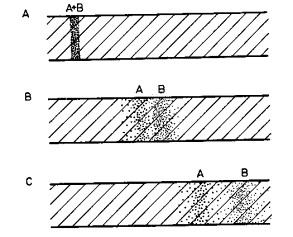 Základní charakteristikou
zónové elektroforézy je to, že vzorek migruje v prostředí základního elektrolytu , který vede prakticky veškerý elektrický proud.
Platí, že složení základního elektrolytu je konstantní podél celé migrační
dráhy a nemění se s časem. Díky tomuto konstantnímu složení základního
elektrolytu, který nejen vede elektrický proud, ale i pufruje potřebnou vlastnost elektrolytu (např. pH ),
jsou efektivní mobility látek
vzorku konstantní. Pro separaci je ale nutné, aby efektivní mobility a tím i
migrační rychlosti byly navzájem různé. Takový stav se dociluje vhodnou volbou
základního elektrolytu. Separace probíhá tak, že do daného místa (startu) se
nanese vzorek a po vložení elektrického pole začne protékat elektrický proud,
látky A a B migrují navzájem různými, ale každá svou konstantní rychlostí. Čím
déle elektroforéza probíhá, tím více se separované zóny od sebe vzdalují a
vlivem difúze se "rozmývají".
Základní charakteristikou
zónové elektroforézy je to, že vzorek migruje v prostředí základního elektrolytu , který vede prakticky veškerý elektrický proud.
Platí, že složení základního elektrolytu je konstantní podél celé migrační
dráhy a nemění se s časem. Díky tomuto konstantnímu složení základního
elektrolytu, který nejen vede elektrický proud, ale i pufruje potřebnou vlastnost elektrolytu (např. pH ),
jsou efektivní mobility látek
vzorku konstantní. Pro separaci je ale nutné, aby efektivní mobility a tím i
migrační rychlosti byly navzájem různé. Takový stav se dociluje vhodnou volbou
základního elektrolytu. Separace probíhá tak, že do daného místa (startu) se
nanese vzorek a po vložení elektrického pole začne protékat elektrický proud,
látky A a B migrují navzájem různými, ale každá svou konstantní rychlostí. Čím
déle elektroforéza probíhá, tím více se separované zóny od sebe vzdalují a
vlivem difúze se "rozmývají".
Zónová elektroforéza se v současnosti provádí převážně v
plošných uspořádáních v tenkých vrstvách gelů či na fólii acetátové celulózy.
Elektroforéza na papíře již ztratila pro oblast klinické chemie svůj význam.
Největší význam má zónová elektroforéza na polyakrylamidovém gelu a
agaróze. Tloušťky gelových vrstev jsou 0,2 - 1 mm,
používají se pufry o koncentracích 0,005 - 0,05 mol/l. Intenzity elektrického
pole jsou 20 - 100 V/cm, takže napětí mezi elektrodovými komorami, mezi nimiž
je migrační dráha (deska s gelem), bývá 400 - 2500 V, proud 20 - 200 mA podle
vodivosti používaného pufru a termoregulační schopnosti (možnosti chlazení
obvykle dovolují pracovat s výkony 0,1 - 0,2 W/cm2). Vzorky se
dávkují do jamek v gelu nebo se aplikují pomocí proužků filtračního papíru
položeného na gel. Dávkované objemy jsou 1 - 5 µl vzorku.
V praxi se zónová elektroforéza vyskytuje v několika
modifikacích, kdy zónová migrace látek je kombinována s dalšími efekty -
příklady:
a.
SDS - elektroforéza
Bílkoviny k separaci jsou
modifikovány tvorbou komplexů s dodecylsulfátem sodným (sodium dodecyl
sulphate, SDS), vzniklé komplexy mají prakticky stejný povrchový záporný náboj
a v zónově elektroforetickém uspořádání se dělí podle molekulových hmotností
b.
Afinitní elektroforéza
Na stabilizačním gelu je
imobilizována látka, která se selektivně váže na analyzovanou bílkovinu, při
elektroforéze na vzniklém afinitním gelu je pak příslušná bílkovina selektivně
zpomalována.
c.
Imunoelektroforéza
Má řadu vlastních variant,
principem je vždy selektivní interakce a precipitace analyzované bílkoviny s
její protilátkou.
d.
Preparativní zónová elektroforéza
Gel je po separaci rozřezán a
jednotlivé frakce jsou z nařezaných dílů eluovány.
e.
Kapilární zónová elektroforéza
Pracuje
s volnými roztoky, umožňuje práci s velkými intenzitami elektrického pole a tím
dosahuje krátkých dob analýzy.
Jaroslava Vávrová