Abstrakt
Polymerázová řetězová reakce (polymerase chain
reaction – PCR) je nejčastěji používanou molekulárně-biologickou amplifikační
technikou v diagnostice. Cílová DNA bývá často ve vzorcích
analyzovaných většinou pro účely genotypizace nebo detekce mikroorganizmů
přítomna v tak nízkých koncentracích, že ji není možno po izolaci přímo
detekovat. Proto je nezbytné zvýšit analytickou sensitivitu její mnohonásobnou
replikací.
Související
informace
Molekulárně-biologické techniky
Text
PCR umožňuje amplifikaci DNA fragmentů až do
velikosti 30000 párů bází (bp), Běžně
se však používá amplifikace úseků DNA o velikosti jen 200 – 400 bp. Mezi další
amplifikační techniky pro DNA patří Q-beta amplifikace, ligázová řetězová
reakce (LCR) nebo NASBA (nucleic acid sequence-based amplification).
PCR je in vitro metoda pro enzymatickou syntézu
specifických sekvencí DNA. Tyto sekvence jsou definovány tzv. primery, které se
hybridizují s komplementárními úseky
DNA, která má být amplifikována, pokud takovéto úseky obsahuje. Primery jsou
tedy krátké jednořetězcové molekuly DNA (oligonukleotidy), jejichž sekvence je
komplementární k jednomu ze dvou řetězců analyzované DNA.
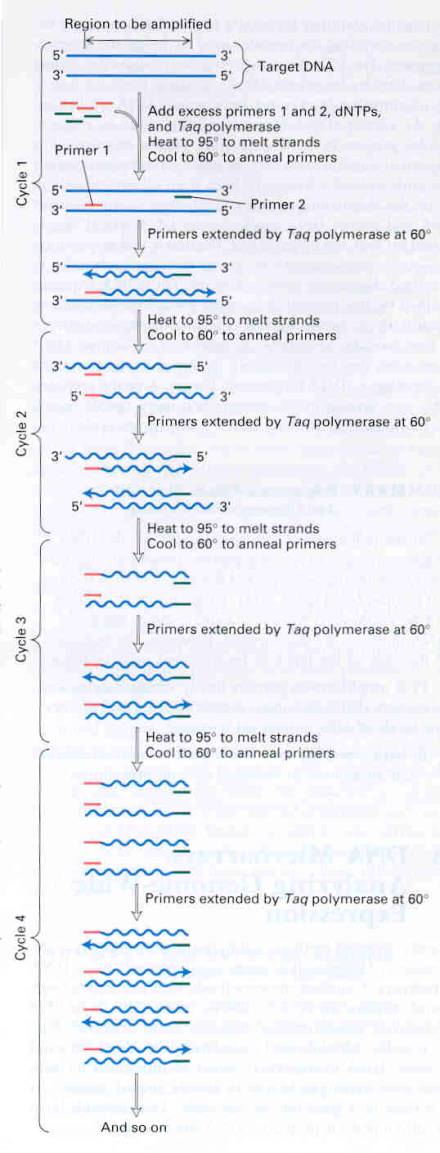
Zvýšením teploty nad 90oC je dvouvláknová
DNA reversibilně rozdělena na jednoduché samostatné řetězce (fáze denaturace).
Po snížení teploty na cca 50oC se primery přítomné v reakčním
mediu vážou na komplementární sekvence denaturované DNA dříve, než stačí DNA
renaturovat (fáze přikládání – annealing). Po zvýšení teploty na cca 70oC
polymeráza přítomná v reakčním mediu prodlužuje přiložené primery
přidáváním nukleotidů, které jsou rovněž přítomny v nadbytku v reakčním
mediu v pořadí, které je dáno pořadím komplementárních nukleotidů
v denaturované DNA (fáze elongace, extenze). Nakonec je teplota zvýšena
opět nad 90oC a je zahájen druhý cyklus amplifikace. Od druhého cyklu jsou vytvářeny (až na
původní dva páry analyzované DNA) úseky DNA o stejné velikosti zakončené
primery, které se nazývají amplicony. Poněvadž polymerázy jsou získávány
z termofilních bakterií, zůstávají aktivní i po více než 30-40 proběhlých
cyklech. Celá reakce se provádí v zařízeních, které se nazývají cyclery.
Ty umožňují velmi rychlé změny teploty v reakčních zkumavkách či
kapilárách. Jeden cyklus tak trvá obvykle kolem 2 min. Teoreticky se množství
ampliconů každým cyklem zdvojnásobuje. V praxi však výtěžnost amplifikační
reakce bývá nižší. Přesto při aplikaci cca 30 cyklů získáme zhruba 109-krát
více úseků specifikované DNA než bylo v původním materiálu. Poněvadž tyto
úseky jsou stejně dlouhé, zjednodušuje se významně možnost jejich detekce.
Amplicony mohou být detekovány nejjednodušeji a nejlevněji po jejich
elektroforetické separaci v agaróze a vizualizaci pomocí ethidium bromidu
pod UV lampou. ELISA techniky za použití vhodných prób (krátké úseky DNA
komplementární s částí ampliconu) dovolují sice určitou kvantifikacu
ampliconů, jsou však poměrně drahé. V poslední době se začínají stále více
uplatňovat metodiky nazvané PCR v reálném čase (RT-PCR), které používají
fluoreskující detekční sondy přímo
v reakčním mediu a jsou prováděny na přístrojích, které jsou kombinací
cycleru a fluorometru. Metodika provádění PCR klade extrémní nároky na
dodržování správné laboratorní práce. Amplicony jsou totiž ideální cílové
struktury pro primery a kontaminace analyzovaného materiálu amplicony
z prostředí laboratoře
způsobuje falešně pozitivní výsledky. Proto při
provádění PCR platí zásada oddělených prostorů pro přípravu materiálu
k amplifikaci, pro vlastní amplifikaci a detekci ampliconů, přičemž pohyb
osob a materiálu musí probíhat jen v uvedením směru . Schéma PCR reakce je
uvedeno na obrázku.
|
|
Literatura
1.
Hubert
K.: Amplification technics in Thomas L.: Clinical Laboratory Fiagnostics. First
Edition, TH-Books Frankfurt/Main, 1998, str. 1449-1452
2.
Lodish
H. et al.: Molecular Cell Biology 4.0. Media Connected, W.H.Freeman and
Company, New York, 2000, str.246-248
Autorské
poznámky
Ivo Lochman