Abstrakt
Cyklosporin A (CyA) je
cyklický polypeptid, který představuje první přírodní látku se selektivním
imunosupresivním účinkem. Cyklosporiny jsou produkovány vláknitými půdními
houbami Typocladiumum inflatum, Cylindrocarpon lucidum a dalšími kmeny půdních
hub. Imunosupresivní účinek CyA byl objeven v roce 1972. V prvých
letech byl používán při orgánových transplantacích, kde výrazně zlepšil
přežívání pacientů i orgánů, které byly pacientům
transplantovány. V roce 1974 byl prokázán u CyA i protizánětlivý účinek
při léčbě autioimunitních onemocnění.
CyA je metabolizován
v játrech systémem jaterních enzymů monooxidáz cytochromu P 450.
Biotransformací CyA vzniká až několik desítek metabolitů, které mohou mít jak
imunosupresivní, tak toxické účinky.
Vlastní CyA vykazuje kromě imunosupresivních vlastností i
některé toxické účinky (nefrotoxicitu, hepatotoxicitu a neurotoxicitu).
Biologická dostupnost CyA je nesmírně variabilní a kolísá od 5 do 70 % (průměr
30 %). Koncentrace CyA jsou proto běžně monitorovány v krvi.
Koncentrace CyA je nutno
udržet v úzkém terapeutickém okně po celou dobu imunosupresivní léčby,
která v případě transplantací trvá do konce života. Monitorování je možné
buď pomocí HPLC metod nebo imunoanalytických stanovení.
Terminologie
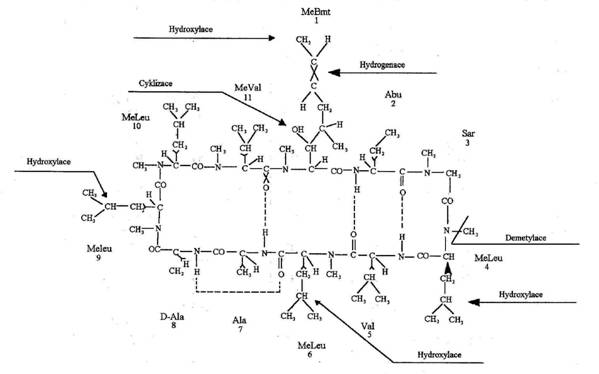
Dekapeptid:
cyclo-[MeBmt-a-Abu-Sar-MeLeu-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal],
kde
MeBmt je (2S,3R,4R,6E)-3-hydroxy-4-methyl-2-methylamino-6-octová kyselina
Synonyma
generický
název: Ciclosporinum
speciality:
Sandimmun, Consupren
jiné označení: CsA
Odkazy na jiné relevantní
dokumenty, další informace
Cyklosporin direct (RIA, Immunotech)
Cyklosporin (RIA, specifický, Immunotech)
Struktura
Cyklosporin A je cyklický
undekapeptid se strukturou cyclo-[MeBmt-a-Abu-Sar-MeLeu-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal], kde MeBmt je
(2S,3R,4R,6E)-3-hydroxy-4-methyl-2-methylamino-6-octová kyselina. Je to bílá,
krystalická látka bez chuti a zápachu, s molekulovou hmotností 1201 Da. Na
rozdíl od lineárních peptidů cyklosporiny nemají volnou karboxy- ani amino-
skupinu a proto se nerozpouští ve vodě, ale jsou rozpustné v tucích a
organických rozpouštědlech. Jsou schopné vystupovat jako ligandy a tvořit
komplexy s některými kationy. CyA je velmi stálý a jeho cyklická struktura
se rozpadá až za působení silných kyselin a zvýšené teploty. V organických
rozpouštědlech za přítomnosti kyselin vznikají izocyklosporiny. Existuje celá
řada reakcí CyA, při níž dochází k modifikaci na jednotlivých
aminokyselinách bez otevření cyklického skeletu. Komplikovanou směs produktů se
podařilo rozšifrovat až s použitím kombinace kapalinové chromatografie
a hmotnostní spektrometrie.
Obrázek 1: Struktura CyA s lokalizací hlavních míst metabolizace.
Farmakokinetika
Na hladinu CyA
v organismu mají vliv různé faktory. Mezi ně patří hlavně příjem potravy,
stav orgánů, změna vstřebávání v gastrointestinálním traktu, porucha vstřebávání
lipidů, věk, jaterní onemocnění, vyšší hladiny kreatininu a interakce
s ostatními léky. K těmto faktorům se řadí i genetické faktory, jako
je např. polymorfismus cytochromu P-450. Absorpce CyA není úplná a vyznačuje se
významnou intra- a interindividuální variabilitou.
Rozdílná biologické
dostupnost, clearence a dávka CyA přináší široké rozmezí koncentrací CyA
v krvi u jednotlivých pacientů, které mohou mít za následek rozdílnou
odpověď na terapii. Kromě toho po operaci je často nedostatečná nebo variabilní
absorpce CyA a monitorování jeho koncentrace je efektivní prostředek, jak
předejít většině negativních důsledků. Sledování koncentrace CyA hraje
důležitou roli i v monitorování compliance pacientů a v sledování
interakcí s ostatními léky.
Pro optimální dávkování CyA,
zejména při orgánových transplantacích, se strategie TDM (Terapeutic Drug
Monitoring) několikrát revidovala. Většina transplantačních center používá
odběr vzorků pro analýzu CyA v údolních koncentracích (through level), to
je před podáním další dávky léku. Po zavedení mikroemulzní formy CyA, se znovu
diskutovala otázka vhodnosti takovéhoto časování odběrů pro TDM. Bylo
prokázáno, že totální expozice CyA, vyjádřená jako AUC (Area Under the Curve)
je lepším parametrem pro TDM a také lépe koreluje s klinickým stavem, než
koncentrace naměřené před podáním následující dávky. Další studie potvrdily, že
AUC se dá stanovit s dostatečnou přesností i při omezeném počtu odběrů
(sparse sampling). CyA se obvykle měří v intervalu 0-6 hodin po podání, nejčastěji
v nulté, první, druhé nebo třetí hodině. Některá centra však počítají AUC
i z většího počtu odběrů až po 12-ti hodinový interval.
V klinické praxi je CyA
používán zejména perorálně. V České republice jsou zaregistrovány následující přípravky:
Mikroemulgované kapsle, specialita Consupren o síle 25, 50, 100 mg (Galena,
ČR), Sandimmun Neoral 25, 50, 100 mg (Sandoz, Švýcarsko) a Sandimmun Neoral 10
mg (Novartis, Švýcarsko). Z roztoků jsou to Consupren a Sandimmun Neoral
v koncentraci 100 mg/ml. Pro parenterální použití (jako infuze) se
používají 5 ml injekce s koncentrací 50 mg/ml.
Na rozdíl od jiných
peptidických léčiv je CyA při perorálním podání dostatečně stabilní.
V kyselém prostředí žaludku může podléhat reverzibilní konverzi na
izocyklosporin A jen asi 2 % CyA. Množství absorbovaného léčiva je závislé na
celkovém podaném množství léčiva a na rychlosti, s jakou se léčivo
uvolňuje z lékové formy. Pro farmakokinetiku CyA je charakteristická
výrazná variabilita biologické dostupnosti, která je u zdravých dobrovolníků
průměrně 30 % (od 5 do 70 %). CyA je absorbován především v tenkém střevě,
proto je délka tenkého střeva důležitý faktor absorpce a s tím souvisí
také potřeba větší dávky CyA u dětí. Variabilita biologické dostupnosti CyA
může být způsobena zhoršenou absorpcí. Koncentrace CyA po perorálním podání
dosahuje vrcholu u většiny pacientů za dobu 1-2 hodiny po podání mikroemulzní
formy.
CyA je primárně vylučován
žlučí. Pouze 6 % z perorální aplikace se vylučuje močí, přičemž pouze 0,1
% je vyloučeno v nezměněné formě. Jeho eliminační poločas je 6–20
hodin, průměr 10 hodin. Některé farmakokinetické parametry jsou uvedeny
v tabulce.
Tabulka č. 1. Základní farmakokinetické
parametry cyklosporinu A
|
Charakteristika |
Cyklosporin A |
|
Čas maximální
koncentrace po podání dávky (Tmax) |
1-8 hodin |
|
Biologická dostupnost
(F) |
2-89 % (průměr: 30 %) |
|
Distribuční objem (Vd) |
0,9-4,8 l/kg (průměr:
3,5 l/kg) |
|
Clearance (Cl) |
2,0-11,8 ml/min/kg
(průměr: 4,5 ml/min/kg) |
|
Poločas eliminace (t1/2) |
6-20 hodin (průměr:
10 hodin) |
|
CyA vázaný na krevní
buňky |
60 % |
|
CyA vázaný na
plazmatické lipoproteiny |
85-90 % |
Distribuční objem
Distribuční
objem se pohybuje od 0,9 do 4,8 l/kg s průměrem 3,5 l/kg.
Biologický poločas
Biologický poločas CyA je
mezi
Vazba na proteiny
CyA v organismu
cirkuluje v krvi vázán na buněčné membrány krvinek nebo na plazmatické
lipoproteiny. V erytrocytech se váže 41-58 % CyA, 4-9 %
v lymfocytech a v plazmě se nachází CyA v 33-47 % (z 90 % je vázán na
lipoproteiny). V plazmě se naměří jen zhruba 40 % obsahu CyA
v systémové cirkulaci.
Vzhledem i k teplotně
závislé distribuci CyA mezi krevní elementy a lipofilní částice séra, se podle
doporučení z Lake Louise z roku 1995 jednoznačně užívá pro TDM plná
nesrážlivá krev s přídavkem
EDTA (1–2 mg/ml krve) s následnou
extrakcí CyA, obvykle metanolem.
Způsob vylučování nebo
metabolismu
CyA je první přírodní
látka se selektivním imunosupresivním účinkem na lymfoidní buňky a to zejména
na T lymfocyty. Z přírodních cyklosporinů vykazují imunosupresivní
účinek cyklosporin A, C, D, G a M. Jednotlivé cyklosporiny se liší pouze
v jedné aminokyselině. Největší imunosupresivní a protizánětlivý účinek má
však CyA (CyA>CyD>CyC).
CyA je indikován
k potlačení patologické imunitní reakce při autoimunitních chorobách,
k inhibici normální imunitní reakce při transplantacích orgánů a
k profylaxi rejekcí u transplantací kostní dřeně. CyA má lepší specifické
účinky než jiná imunosupresiva. Zasahuje specificky do imunitního systému, kde
tlumí tvorbu cytotoxických T lymfocytů.
Imunosupresivní účinek CyA
spočívá ve schopnosti inhibovat metabolické dráhy zapojené do přenosu signálu
z receptorů T lymfocytů do jádra a tím blokovat časnou aktivaci genů pro
syntézu lymfokinů na úrovni transkripce. CyA se váže na T lymfocyty
nespecificky fyzikálně-chemickou interakcí s lipidy v buněčné
membráně. CyA interaguje nespecificky s libovolným povrchem, ale
specificky ovlivňuje pouze funkci T lymfocytů. Jeho imunosupresivní účinek je
zprostředkován intracelulárním vazebným proteinem cyklofilinem, který vykazuje
enzymatickou aktivitu peptidyl-propyl izomerázy. Komplex CyA-cyklofilin
selektivně inhibuje calcineurin, což je enzym se serin-threonin
fosfatázovou aktivitou s nezbytnou spoluúčastí Ca+2 iontů.
Inhibicí této fosfatázy v aktivovaných T lymfocytech je podstatně
redukována translokace cytoplasmatické subjednotky NFAT (nuclear
faktor of activated T lymfocytes) do jaderného kompartmentu s následným
narušením transkripce genu pro interleukin-
Léčba CyA je spojena
s vážnými toxickými vedlejšími účinky. Primárně se jedná o nefrotoxicitu a
hepatotoxicitu, popisována je i neurotoxicita.
Aktivní metabolity
Cyklosporiny jsou
metabolizovány enzymatickým systémem monooxygenáz, katalyzovaných jaterním
cytochromem P-450, přičemž zůstává zachována jejich cyklická struktura. Na
metabolizaci CyA se v největší míře podílí nejdůležitější člen podjednotky
P-450 3A, P-450 3A4. Celkově je dnes známo asi 30 metabolitů CyA.
Nejvýznamnějšími a nejvíce prostudovanými metabolity z hlediska toxicity a
klinického účinku jsou metabolity AM1 (M17), AM4N (M21) a AM9 (M1).
Clearance
Clearence
CyA (z krve) se pohybuje od 5 – 7 ml/min/kg u dospělých po transplantaci jater
a ledvin u dospělých a od 8 do 10 ml/min./kg u pacientů po transplantaci kostní
dřeně. Primární eliminační cestou CyA je exkrece žlučí. Jen velmi malé množství
0,1 až 6 % podané dávky se vylučuje ledvinami. CyA přechází do mateřského
mléka.
Interakce s jinými léky ovlivňujícími biologickou dostupnost
Protože
CyA je intenzivně metabolizován cytochromem P-450 3A4, a ten se podílí na
metabolismu více než 50 % všech léků, jsou interakce jednotlivých léků
významné. Léky na bázi fenytoinu, fenobarbitálu, valproové kyseliny,
karbamazepinu,a rifampicinu indukují systém cytochromu P-450, jestliže jsou
podávány souběžně s CyA, zvyšují metabolismus CyA a tedy snižují
koncentrace CyA v systémové cirkulaci.
Na druhé straně léky na bázi
ketokonazolu, erytromycinu, varapamilu a diltiazenu inhibují cytochrom P-450,
snižují metabolismus CyA a takto zvyšují koncentrace CyA v systémové
cirkulaci.
Literatura
Holt D. W., Johnston A.,
Roberts N. B., Tredger J. M. and Trull A. K. (1994) Methodological and
clinical aspects of cyclosporin monitoring report of the Association of
Clinical Biochemists task force. Ann Clin Biochem. 31: 424-427
Oellerich M., Armstront
V.W., Kahan B., Shaw L., Holt D.W., Yatscoff R. et al.: Lake Louise consensus
conference on cyclosporin monitoring in organ transplantation: report of the consensus
panel. Ther Drug Monit 17, (1995), 642-654
Maťha V. a kol. (1994)
Cyklosporin A. Grada Publishing.
Poznámky
CyA se používá
při imunosupresivní léčbě u pacientů s transplantov\nými orgány, ale
i u autoimunitních nemocí většinou v kombinaci s jinými léky a
imunosupresivy (azathioprin, kortikoidy, mofetylester kyseliny mykofenolové,
tacrolimus, antithymocytární a antilymfocytární protilátky).
Úzké terapeutické rozmezí a
velká interindividuální variabilita farmakokinetiky CyA vyžaduje rutinní
monitorování jeho koncentrací v krvi. V současné době se používá pro
monitorování CyA několik metod, které zahrnují stanovení pomocí vysokoúčinné
kapalinové chromatografie (HPLC) a různé druhy imunoanalytických metod jako je
klasická radioimunoanalýza (RIA) nebo některé formy automatizovaných
neizotopových variant imunoanalýzy, především enzymoimunonanalýzy: FPIA –
“fluorescence polarization imunoassay”, EMIT – “enzyme–multiplied immunoassay
techniques” a CEDIA – “cloned enzyme-donor immunoassay”. Standardní metodou je
dobře validovaná HPLC metoda stanovení CyA. Tyto metody jsou však poměrně drahé a
časově velmi náročné, proto se častěji používají imunoanalytické metody. Obecně
lze říci, že všechny imunoanalytické metody nadhodnocují výsledky koncentrací
CyA v důsledku zkřížených reakcí s jednotlivými metabolity CyA, které
jsou přítomny v krvi.
Mezi doporučeními
publikovanými v materiálech z konference v Lake Louise
v roce 1995 byla uvedena kriteria, které musí splňovat metoda, aby mohla
být použita pro TDM CyA u pacientů léčených CyA. Pro reprodukovatelnost: £10 % při koncentraci 50 mg/l a
£5 % při koncentraci 300 mg/l. Pro správnost pak bylo publikováno kriterium pro
srovnání s validovanou HPLC metodou. Směrnice korelace metod se musí
pohybovat v intervalu 0,9–1,1 a intercept od –15 mg/l do +15 mg/l, Sy/x £15 mg/l.
Většina center v současné době používá relativně specifické
imunoanalytické metody stanovení CyA. Zatímco radioizotopové metody jsou
víceméně na ústupu, přibývá zejména automatizovaných imunoanalytických metod.
V tabulce č. 2 jsou uvedena
terapeutická rozmezí CyA pro monitorování při transplantaci ledvin, srdce a
jater tak, jak byly určeny pro jednotlivé metody při podávání iniciální i
udržovací dávky, podle konsenzuálního doporučení.
Tabulka č. 2: Doporučené
terapeutické rozmezí koncentrací cyklosporinu A (údolní koncentrace) u
jednotlivých transplantovaných orgánů.
|
Metoda |
Ledviny |
Srdce |
Játra |
|
|
trojkombinace |
trojkombinace |
trojkombinace |
dvojkombinace |
|
|
Iniciální dávka |
[mg/l] |
[mg/l] |
[mg/l] |
[mg/l] |
|
HPLC |
150-225 |
250-325 |
225-300 |
|
|
FPIA |
250-375 |
300-400 |
250-313 |
300-375 |
|
I-RIA |
160-200 |
250-325 |
250-300 |
|
|
EMIT |
125-200 |
275-375 |
|
125-200 |
|
Udržovací dávka |
[mg/l] |
[mg/l] |
[mg/l] |
[mg/l] |
|
HPLC |
100-150 |
125-175 |
100-150 |
100-150 |
|
FPIA |
100-250 |
150-250 |
135-200 |
150-250 |
|
I-RIA |
75-150 |
90-160 |
150-238 |
|
|
EMIT |
75-150 |
150-250 |
|
|
Autorské poznámky
Kristian Šafarčík