Abstrakt
Chromatografick├ę techniky spo─Ź├şvaj├ş v r┼»zn├Żch
fyzik├íln─Ť-chemick├Żch principech d─Ťlen├ş sm─Ťsi l├ítek na jednotliv├ę slo┼żky.
Mechanismus chromatografick├ęho d─Ťlen├ş vyu┼ż├şv├í zadr┼żen├ş (retenci) sm─Ťsi stacion├írn├ş
f├íz├ş a postupn├ę a opakovan├ę vytv├í┼Öen├ş rovnov├í┼żn├Żch stav┼» d─Ťlen├Żch l├ítek mezi
p┼Ö├ştomn├Żmi f├ízemi.
Souvisej├şc├ş informace
Text
Z├íkladn├ş informace o chromatografick├Żch technik├ích jsou
rozd─Ťleny podle sch├ęmatu:
1.
Chromatografick├ę
metody - úvod, přehled
2.
Faktory
ovliv┼łuj├şc├ş chromatografick├ę d─Ťlen├ş
A. Termodynamick├ę faktory
separace
B. Kinetick├ę faktory separace
3.
Základy
hodnocen├ş chromatografick├Żch dat
4.
P┼Ö├şprava
vzorků
5.
Derivatizace
1.
Chromatografick├ę metody - ├║vod, p┼Öehled
Principi├íln├ş z├íklad v┼íem chromatografick├Żm technik├ím
polo┼żil na po─Ź├ítku dvac├ít├ęho stolet├ş M.S. Cvet (1872 - 1919), rusk├Ż botanik,
fyziolog a biochemik, kdy┼ż rozd─Ťlil na sloupci sorbentu listov├í barviva.
P┼Öehled chromatografick├Żch
metod
|
Mobiln├ş f├íze |
Stacion├írn├ş f├íze |
Mechanismus d─Ťlen├ş |
Metoda |
|
plyn |
kapalina |
rozd─Ťlov├ín├ş, rozd─Ťlovac├ş, |
plynov├í rozd─Ťlovac├ş |
|
|
|
rovnováha |
chromatografie (GLC) |
|
|
pevná
látka |
adsorpce, adsorp─Źn├ş |
plynov├í adsorp─Źn├ş |
|
|
|
izoterma |
chromatografie (GSC) |
|
|
|
s├ştov├Ż efekt |
plynová chromatografie |
|
|
|
|
na molekulov├Żch s├ştech (GSC) |
|
kapalina |
kapalina |
rozd─Ťlov├ín├ş, rozd─Ťlovac├ş |
kapalinov├í rozd─Ťlovac├ş |
|
|
|
rovnováha |
chromatografie (LLC) |
|
|
|
s├ştov├Ż efekt |
gelov├í permea─Źn├ş |
|
|
|
|
chromatografie (GPC) |
|
|
pevná
látka |
adsorpce, adsorp─Źn├ş |
kapalinová chromatografie |
|
|
|
izoterma |
adsorp─Źn├ş (LSC) |
|
|
|
|
tenkovrstvá |
|
|
|
|
chromatografie (TLC) |
|
|
|
iontov├í v├Żm─Ťna, |
ionexová chromatografie |
|
|
|
v├Żm─Ťnn├í rovnov├íha |
(IEC) |
|
|
|
biospecifická chemická |
afinitn├ş |
|
|
|
chemická reakce |
chromatografie |
Stacion├írn├ş (nepohybliv├í) f├íze - je um├şst─Ťna v kolon─Ť
(vrstv─Ť), m┼»┼że b├Żt p┼Öedstavov├ína ─Ź├íste─Źkami pevn├ę hmoty ( stacion├írn├ş f├íze v kapalinov├ę chromatografii ) nebo kapalinou zakotvenou na povrchu inertn├şho
nosi─Źe.
Mobiln├ş (pohybliv├í) f├íze - (plyn, kapalina) un├í┼í├ş
separovan├ę slo┼żky lo┼żem stacion├írn├ş f├íze.
2. Faktory ovliv┼łuj├şc├ş chromatografick├ę d─Ťlen├ş
Termodynamick├ę faktory separace
Termodynamick├ę faktory separace
zahrnuj├ş vliv interakce chromatografovan├Żch slo┼żek se sorbentem a z toho
vypl├Żvaj├şc├ş i rozd├şln├ę mechanismy separace. Hlavn├şmi principy
chromatografick├ęho d─Ťlen├ş jsou adsorpce, rozd─Ťlov├ín├ş mezi dv─Ť f├íze, chemisorpce
a s├ştov├Ż efekt.
(a)
Adsorpce na pol├írn├şch adsorbentech a chemisorpce
P┼Öi adsorpci molekul na tuh├Żch
adsorbentech doch├íz├ş k jejich zachycov├ín├ş na povrchu tuh├ę f├íze. Jestli┼że
pronikaj├ş p┼Öes rozhran├ş tuh├ę f├íze a difunduj├ş do jej├şho objemu, jedn├í se o
adsorpci. Rozhoduj├şc├ş v├Żznam p┼Öi adsorpci m├í velikost a jakost povrchu
adsorbentu, kde se nach├íz├ş tzv. adsorp─Źn├ş centra. Z├ívislost adsorbovan├ęho
mno┼żstv├ş l├ítky na koncentraci t├ę┼że l├ítky v okoln├şm prost┼Öed├ş ud├ív├í adsorp─Źn├ş
izoterma. V re├íln├Żch syst├ęmech se uplat┼łuj├ş dv─Ť izotermy, a to Langmuirova a
Freundlichova.
|
|
|
|
(b)
Rozd─Ťlov├ín├ş mezi dv─Ť nem├şsiteln├ę f├íze
Tento mechanismus převládá v
plynov├ę chromatografii. Dostanou-li se do styku dv─Ť nem├şsiteln├ę f├íze (ob─Ť
kapaln├ę, nebo kapaln├í a plynn├í) z nich┼ż jedna obsahuje ur─Źitou slo┼żku (sm─Ťs
l├ítek) a druh├í nikoli, difunduje tato do ─Źist├ę f├íze tak, aby byl zachov├ín ur─Źit├Ż
pom─Ťr, kter├Ż je za dan├Żch podm├şnek konstantn├ş. Hnac├ş silou tohoto parti─Źn├şho
procesu je rozd├şl koncentrac├ş slo┼żky v jedn├ę a druh├ę f├ízi, proto┼że syst├ęm m├í
snahu dostat se do rovnováhy.
(c)
S├ştov├Ż efekt
Na principu s├ştov├ęho efektu
jsou zalo┼żeny dv─Ť techniky. V plynn├ę f├ízi je to chromatografie na molekul├írn├şch
s├ştech vyu┼ż├şvaj├şc├ş rozd├şln├Żch, p┼Öesn─Ť definovan├Żch p├│r┼» sorbentu k separaci
plyn┼» podle velikosti pr┼»m─Ťru jejich molekul ─Źi atom┼». V kapaln├ę f├ízi jde
o┬á gelovou permea─Źn├ş chromatografii .
(d)
Vzájemná interakce molekul
Sorpce l├ítek je podm├şn─Ťna
silami, jimi┼ż na sebe p┼»sob├ş navz├íjem sorbent a sorbovan├í l├ítka. Jedn├í se o
s├şly nepol├írn├ş (van der Waalsovy) a pol├írn├ş (indukovan├ę, disperzn├ş, vazebn├ę),
kter├ę se mohou uplat┼łovat (interakce vzorek - vzorek, vzorek - sorbent, vzorek
- mobiln├ş f├íze).
Kinetick├ę faktory separace
Kinetick├ę faktory zahrnuj├ş
vlivy rychlosti pr┼»toku mobiln├ş f├íze, dif├║ze slo┼żek v mobiln├ş i stacion├írn├ş
f├ízi atd. na roz┼íi┼Öov├ín├ş elu─Źn├şch k┼Öivek. K vysti┼żen├ş t─Ťchto vliv┼» se zav├íd─Ťj├ş
pojmy teoretick├ę patro, kapacitn├ş pom─Ťr, ├║─Źinnost a dal┼í├ş. M├şra relativn├ş
separace dvou l├ítek se naz├Żv├í rozli┼íen├ş. Rozli┼íen├ş je z├ívisl├ę na vztahu mezi
selektivitou, kapacitou a ├║─Źinnost├ş.
(a)
Teoretick├ę patro
Teoretick├ę patro je m├şrou ├║─Źinnosti
chromatografick├ęho syst├ęmu, bezprost┼Öedn─Ť s n├ş souvis├ş tvar elu─Źn├ş k┼Öivky.
Vlivy dif├║ze b─Ťhem chromatografick├Żch pochod┼» se projevuj├ş roz┼íi┼Öov├ín├şm elu─Źn├ş
k┼Öivky. Je-li zn├íma celkov├í d├ęlka kolony (L), je mo┼żno vypo─Ź├ştat v├Ż┼íku (H)
ekvivalentn├ş teoretick├ęmu patru, na jej├şm┼ż z├íklad─Ť se porovn├ívaj├ş ├║─Źinnosti
jednotliv├Żch chromatografick├Żch kolon.
(b)
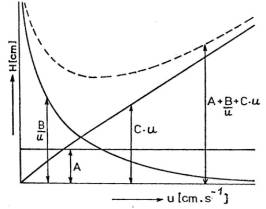
Dif├║zn├ş teorie
Tato teorie respektuje
neide├íln├ş chov├ín├ş slo┼żek v chromatografick├ę kolon─Ť a p┼Öipisuje projevy tohoto
chov├ín├ş t┼Öem hlavn├şm vliv┼»m: turbulentn├ş dif├║zi v mobiln├ş f├ízi (HT),
molekul├írn├ş dif├║zi v mobiln├ş f├ízi (HM) a odporu v┼»─Źi p┼Öevodu hmoty
na f├ízov├ęm rozhran├ş (HO). Tyto vlivy jsou nez├ívisl├ę a pod├şl├ş se na
v├Ż┼íce ekvivalentn├ş teoretick├ęmu patru:
H = HT + HM
+ HO
Souvislost mezi dif├║zn├şmi vlivy
a line├írn├ş rychlost├ş mobiln├ş f├íze odvodil van Deemter. V nejjednodu┼í┼í├şm tvaru
má van Deemterova rovnice tvar:
H = A + B/u + C * u
|
|
kde: A - faktor vlivu turbulentn├ş dif├║ze, B - faktor vlivu molekul├írn├ş dif├║ze, C - faktor vlivu odporu v┼»─Źi p┼Öevodu hmoty, u - st┼Öedn├ş line├írn├ş rychlost toku mobiln├ş f├íze. |
(c)
Rozli┼íen├ş
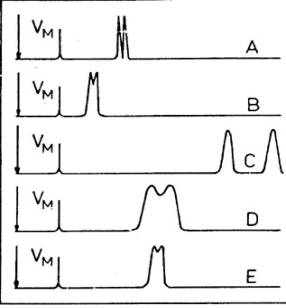
C├şlem chromatografie je
dos├íhnout dobr├ęho rozd─Ťlen├ş analyzovan├Żch l├ítek v p┼Öijateln├ęm ─Źase. Rozd─Ťlen├ş
m┼»┼że b├Żt ├║pln├ę, ─Ź├íste─Źn├ę, nedokonal├ę. Kvantitativn─Ť je zavedena m├şra relativn├ş
separace dvou l├ítek a naz├Żv├í se rozli┼íen├ş R1,2.
Z praktick├ęho hlediska je t┼Öeba
v─Ťd─Ťt, jak lze rozli┼íen├ş m─Ťnit, kter├ę faktory a jak hodnotu rozli┼íen├ş
ovliv┼łuj├ş:
R1,2 = Fselektivity
* Fkapacity * F├║─Źinnosti
Faktor selektivity
Selektivita syst├ęmu dan├í volbou
stacion├írn├ş a mobiln├ş f├íze hraje v chromatografii rozhoduj├şc├ş ├║lohu. Separace
slo┼żek u instrument├íln─Ť nejjednodu┼í┼í├şch technik jako jsou pap├şrov├í a
tenkovrstv├í chromatografie je zalo┼żena pouze na selektivit─Ť syst├ęmu. Selektivn├ş
faktor je faktorem termodynamick├Żm a je n─Ťkdy vyjad┼Öov├ín pomoc├ş separa─Źn├şho
faktoru a, kter├Ż je roven pom─Ťru distribu─Źn├şch konstant.
Lze odvodit, ┼że rozli┼íen├ş je ├║m─Ťrn├ę v├Żrazu (1 - a).
Hodnotu rozli┼íen├ş je mo┼żno
ovlivnit:
-
zm─Ťnou
stacion├írn├ş f├íze,
-
zm─Ťnou
mobiln├ş f├íze,
-
sou─Źasnou
zm─Ťnou obou f├íz├ş,
-
zm─Ťnou
rychlosti toku mobiln├ş f├íze.
|
|
Faktor kapacity
Kapacitn├ş pom─Ťr k je
bezrozm─Ťrn├í veli─Źina ud├ívaj├şc├ş hodnotu retence separovan├ę slo┼żky:
k  =  KD
* Vs/Vm
kde: KD - distribu─Źn├ş
konstanta, Vs a Vm jsou objemy stacion├írn├ş a mobiln├ş
fáze.
Hodnota rozli┼íen├ş roste se
vzr┼»staj├şc├ş hodnotou kapacitn├şho pom─Ťru. Kapacitn├ş pom─Ťr lze ovlivnit:
-
mno┼żstv├şm
stacion├írn├ş f├íze v kolon─Ť,
-
zm─Ťnou
stacion├írn├ş nebo mobiln├ş f├íze (v HPLC gradientovou eluc├ş),
-
zm─Ťnou
teploty kolony (v GC stup┼łovit├í i gradientov├í).
-
Faktor ├║─Źinnosti
Faktor ├║─Źinnosti je faktorem
kinetick├Żm a ukazuje, ┼że rozli┼íen├ş je ├║m─Ťrn├ę druh├ę odmocnin─Ť celkov├ęho po─Źtu
pater kolony. Faktor ├║─Źinnosti lze ovlivnit:
-
d├ęlkou
kolony,
-
rychlost├ş
pr┼»toku mobiln├ş f├íze,
-
velikost├ş
─Ź├ístic sorbentu,
-
teplotou,
viskozitou mobiln├ş i stacion├írn├ş f├íze apod.
3. Z├íklady hodnocen├ş chromatografick├Żch dat
Vyjad┼Öov├ín├ş v├Żsledk┼» ve v┼íech kolonov├Żch
chromatografick├Żch technik├ích je shodn├ę. Po n├íst┼Öiku vzorku do chromatografick├ę
kolony je un├í┼íen elu─Źn├ş p├ís (sm─Ťsn├í z├│na) mobiln├ş f├íz├ş a na kolon─Ť napln─Ťn├ę
sorbentem doch├íz├ş k jejich separaci (rozd─Ťlen├ş). P┼Öi v├Żstupu slo┼żky sm─Ťsi z
kolony indikuje detektor jej├ş p┼Ö├ştomnost v elu├ítu a zaznamen├ív├í graficky elu─Źn├ş
p├şk (k┼Öivku). Poloha p├şku ud├ív├í dobu, kterou separovan├í slo┼żka setrv├í v kolon─Ť,
tj. elu─Źn├ş (reten─Źn├ş) ─Źas a je kvalitativn├şm pr┼»kazem p┼Ö├ştomnosti dan├ę slo┼żky.
Plocha (v├Ż┼íka) p├şku se kvantifikuje a ud├ív├í mno┼żstv├ş slo┼żky obsa┼żen├ę v
separovan├ę sm─Ťsi.
P┼Öi kvantitativn├ş anal├Żze je t┼Öeba ┼Öe┼íit vztah mezi
plochou (v├Ż┼íkou) p├şku a mno┼żstv├şm slo┼żky ve vzorku a z├şskan├ę v├Żsledky hodnotit
z hlediska p┼Öesnosti a spr├ívnosti. Pro ur─Źen├ş obsahu slo┼żky analyzovan├ęho
vzorku se pou┼ż├şv├í:
a.
Metoda
absolutn├ş kalibrace (metoda vn─Ťj┼í├şho standardu) spo─Ź├şv├í v d├ívkov├ín├ş zn├ím├Żch
mno┼żstv├ş analyzovan├ęho vzorku a standardu za identick├Żch podm├şnek a to bu─Ć
metodou kalibra─Źn├ş k┼Öivky nebo metodou p┼Ö├şm├ęho srovn├ín├ş.
b.
Metoda
vnit┼Ön├şho standardu je zalo┼żena na p┼Öid├ín├ş zn├ím├ęho mno┼żstv├ş jedn├ę l├ítky, kter├í
neinterferuje s ostatn├şmi slo┼żkami sm─Ťsi. Tato metoda eliminuje p┼Ö├şpadn├ę
nep┼Öesnosti v d├ívkov├ín├ş vzorku nebo ztr├íty p┼Öi p┼Öed├║prav─Ť vzorku.
c.
Metoda
standardn├şho p┼Ö├şdavku vyu┼ż├şv├í p┼Öid├ín├ş definovan├ęho mno┼żstv├ş standardu ke
zn├ím├ęmu mno┼żstv├ş vzorku.
4. P┼Ö├şprava vzork┼»
Krom─Ť vlastn├şho analytick├ęho zpracov├ín├ş vzork┼» jsou
v├Żsledky anal├Żz zna─Źn─Ť ovlivn─Ťny i zp┼»sobem odb─Ťru a dal┼í├şm zpracov├ín├şm vzork┼»
p┼Öed anal├Żzou.
Obohacovac├ş techniky a ├║prava vzork┼»
D┼»vody pro pou┼żit├ş:
-
na
chromatografickou kolonu nelze p┼Ö├şmo d├ívkovat biologick├Ż materi├íl,
-
koncentrace
stanovovan├ę l├ítky je pod limitem detekce,
-
stanovovaná
l├ítka je doprov├ízena jin├Żmi l├ítkami, kter├ę ru┼í├ş anal├Żzu.
Techniky úpravy vzorků:
1.
adsorp─Źn├ş
2.
metody
vyu┼ż├şvaj├şc├ş chemick├ę reakce
3.
vymrazovac├ş
(kryogenn├ş)
4.
odlu─Źovac├ş
(trapping)
5.
extrak─Źn├ş
- plynem (headspace), pevnou látkou (SPE), kapalinou (extrakce mezi
nem├şsiteln├Żmi kapalinami, destila─Źn├ş extrak─Źn├ş technika)
6.
ultrafiltra─Źn├ş
V klinick├ę chemii se pou┼ż├şvaj├ş hlavn─Ť techniky extrak─Źn├ş
a ultrafiltra─Źn├ş, ostatn├ş zp┼»soby obohacov├ín├ş vzork┼» se uplat┼łuj├ş p┼Öedev┼í├şm v
technick├ę praxi.
Extrak─Źn├ş techniky:
(a)
extrakce plynem
Pro postupy zahrnuj├şc├ş obecn─Ť
extrakci studovan├ęho materi├ílu plynem a n├ísleduj├şc├ş plynov─Ť chromatografickou
anal├Żzu plynn├ęho extraktu se v┼żil n├ízev headspace anal├Żza. Jedn├í se o postupy,
kter├Żmi se stanovuj├ş obsahy t─Ťkav├Żch slo┼żek kondenzovan├Żch materi├íl┼» anal├Żzou
plynn├ę f├íze, kter├í je v kontaktu (zpravidla v rovnov├íze) s analyzovan├Żm
kondenzovan├Żm materi├ílem. V klinick├ę praxi je pou┼żiteln├í tzv. statick├í
headspace, kdy se analyzuje vzorek plynu odebran├Ż z prostoru nad kondenzovanou
f├íz├ş uzav┼Öen├ęho syst├ęmu, kter├Ż je s n├ş v rovnov├íze (nap┼Ö. anal├Żza t─Ťkav├Żch
látek v krvi).
(b)
extrakce kapalinou
Extrakce mezi dv─Ťma
nem├şsiteln├Żmi kapalinami vyu┼ż├şv├í z├íkonitost├ş Nernstova rozd─Ťlovac├şho z├íkona.
Z├íkladn├ş podm├şnkou je dobr├í rozpustnost sledovan├Żch komponent v pou┼żit├ęm
rozpou┼ít─Ťdle a tak├ę znalost velikosti distribu─Źn├şch konstant v dan├ęm syst├ęmu.
Organick├Ż extrakt se zpravidla odpa┼Öuje v proudu inertn├şho plynu (dus├şku) a
odparek se rozpust├ş p┼Öed aplikac├ş na chromatografickou kolonu v nezbytn├ęm
objemu mobiln├ş f├íze.
(c)
extrakce pevnou látkou (SPE)
Technika izolace, ─Źi┼ít─Ťn├ş nebo
obohacov├ín├ş stanovovan├ę slo┼żky na mal├Żch kolonk├ích (nap┼Ö. velikosti injek─Źn├ş
st┼Ö├şka─Źky) napln─Ťn├Żch sorbentem, iontom─Ťni─Źem, gelem nebo jin├Żm d─Ťl├şc├şm m├ędiem
dle charakteru izolovan├ę l├ítky. Vzorek v roztoku se prol├ęv├í nebo pros├şv├í
podtlakem, zachycen├ę slo┼żky se po promyt├ş uvoln├ş vhodn├Żm rozpou┼ít─Ťdlem.
Pro SPE se ─Źasto vyu┼ż├şv├í p┼Öedev┼í├şm modifikovan├ęho silikagelu:
|
Typ sorbentu (v├ízan├í funk─Źn├ş skupina) |
Typ interakc├ş |
P┼Ö├şklady aplikac├ş |
|
Silikagel O |
adsorpce pol├írn├şch l├ítek |
steroidy, lipidy, org.
kyseliny, |
|
|
l |
l├ę─Źiva |
|
oktadecyl- |
RP* extrakce nepol├írn├şch a |
steroidy, nitraminy |
|
|
st┼Öedn─Ť pol├írn├şch l├ítek |
|
|
kyanopropyl- |
NP** extrakce pol├írn├şch l├ítek |
aminy, alkoholy, barviva, |
|
|
|
fenoly |
|
diol- |
NP extrakce pol├írn├şch l├ítek |
proteiny, peptidy |
|
aminopropyl- (dimethylaminopropyl-) |
extrakce na principu slab├ę iontov├ę v├Żm─Ťny |
peptidy, nukleotidy,
steroidy, vitam├şny, cukry, aminokyseliny |
|
aromatick├ę sulfonov├ę kyseliny |
extrakce na siln├Żch katexech
a RP extrakce (krom─Ť mechanismu iontov├Żch p├ír┼») |
aminokyseliny, katecholaminy,
nukleov├ę b├íze, nukleosidy |
|
kvartern├ş aminy |
extrakce na siln├Żch anexech |
nukleosidy, nukleov├ę
kyseliny, antibiotika |
** RP - syst├ęm obr├ícen├Żch f├íz├ş
** NP - syst├ęm norm├íln├şch f├íz├ş
(d)
Ultrafiltrace
Ultrafiltrace je metoda
obohacov├ín├ş nebo d─Ťlen├ş roztok┼» pomoc├ş polopropustn├Żch membr├ín. Hustota
membr├íny limituje velikost molekul, kter├ę jsou separov├íny. Tato technika je
vhodn├í pro deproteinaci s├ęrov├Żch vzork┼», proveden├ş je mo┼żn├ę i v mal├Żch objemech
vzorku (centrifuga─Źn├ş filtrace ve zkumavk├ích typu Eppendorf).
5. Derivatizace
Derivatiza─Źn├ş techniky vyu┼ż├şvaj├ş specifick├ę reakce p┼Öed,
v pr┼»b─Ťhu chromatografick├ęho procesu, nebo po jeho ukon─Źen├ş p┼Öed vstupem do
detektoru. Smyslem je doc├şlit kvalitativn─Ť nov├Żch vlastnost├ş separovan├Żch
l├ítek, kter├ę umo┼żn├ş p┼Öedseparaci ─Źi separaci v┼»bec, usnadn├ş identifikaci, zv├Ż┼í├ş
citlivost vlastn├ş detekce. Ka┼żd├í z chromatografick├Żch technik klade na
p┼Öipraven├ę deriv├íty jin├ę po┼żadavky. U plynov├ę chromatografie je t┼Öeba doc├şlit
toho, aby vznikaj├şc├ş deriv├íty byly t─Ťkav─Ťj┼í├ş ne┼ż l├ítky p┼»vodn├ş, zat├şmco v
kapalinov├ę chromatografii v plo┼ín├ęm uspo┼Ö├íd├ín├ş je tomu naopak. U kapalinov├ę
kolonov├ę chromatografie nehraje tenze par separovan├Żch slo┼żek v├Żznamnou roli,
ale jde p┼Öedev┼í├şm o vyvol├ín├ş zm─Ťn v rozpustnosti jednotliv├Żch komponent
obsa┼żen├Żch ve sm─Ťsi.
Poznámky
Appendixy
Literatura
Autorsk├ę pozn├ímky
Jaroslava Vávrová