Abstrakt
Vitamin B12 je komplexn├ş slou─Źenina se 4 pyrolov├Żmi j├ídry, kter├í sv├şraj├ş jeden atom kobaltu. Spolu s kyselinou listovou (fol├íty) jsou nezbytn├Żm faktorem p┼Öi synt├ęze DNA a s t├şm souvisej├şc├şm zr├ín├şm ─Źerven├Żch krvinek. Pouze v komplexu s tzv. intrinsic faktorem (protein vylu─Źovan├Ż pariet├íln├şmi bu┼łkami ┼żalude─Źn├ş st─Ťny) je vitamin B12 zachyt├ív├ín receptory na vnit┼Ön├ş st─Ťn─Ť ilea a m┼»┼że se vst┼Öeb├ívat do krve a tk├ín├ş. Vitamin B12 se hromad├ş do z├ísoby v j├ítrech, kostn├ş d┼Öeni a n─Ťkter├Żch dal┼í├şch tk├ín├şch. Lid├ę z├şsk├ívaj├ş vitamin B12 v├Żhradn─Ť z potravy ┼żivo─Źi┼ín├ęho p┼»vodu (maso, ml├ęko, vejce).
Terminologie
Synonyma
Kobalamin
Klasifika─Źn├ş k├│dy
Odkazy na jin├ę relevantn├ş dokumenty, dal┼í├ş informace
Vitam├şn B12 - kobalamin
Vitam├şn B12: metody
Chemick├í a fyzik├íln├ş charakteristika, struktura a povaha analytuOSN-E
Role v metabolismu
Vitamin B12 , respektive jeho aktivn├ş forma v bu┼łk├ích, je pou┼żit jako kofaktor pro ┼Öadu enzym┼». Jedn├í se o methylmalonyl CoA mut├ízu, kter├í katalyzuje transformaci mehylmalon├ít CoA na sukcinyl CoA (reakce je sou─Ź├íst├ş beta oxidace mastn├Żch kyselin, kdy od┼ít─Ťpen├Ż lich├Ż uhl├şkov├Ż atom je nav├íz├ín na kobalamin). V d┼»sledku deficitu vitaminu B12 pak doch├íz├ş k akumulaci MMA (methylmalonov├ę kyseliny) v krvi. Dal┼í├ş d┼»le┼żitou reakc├ş, na n├ş┼ż se pod├şl├ş methylkobalamin je metylace homocysteinu na methionin. Jedn├í se o reakci, kter├í je katalyzov├ína methionin synt├ízou a k jej├şmu┼ż pr┼»b─Ťhu je zapot┼Öeb├ş i fol├ítu ve form─Ť THF (tetrahydrofol├ítu).┬á K metylaci v─Ťt┼íiny protein┼» doch├íz├ş po ribozom├íln├ş transkripci, proto maj├ş proteiny specifick├ę rezidu├íln├ş methylenov├ę zbytky, nap┼Ö. alkalick├Ż myelin, histony, myosin. Ve srovn├ín├ş s nimi jin├ę ( cytosinov├ę, guaninov├ę zbytky v DNA, RNA) jsou methylov├íny specifick├Żmi methyltransfer├ízami. V┼íechny methyltransfer├ízy pak pou┼ż├şvaj├ş SAM ( S-adenosylmethionin) jako zdroj methylov├Żch skupin. SAM je syntetizov├ín z ATP a methioninu S-adenosylmethionin synt├ízou. V├Żsledkem podpory metyla─Źn├şch reakc├ş je vznik SAH (S-adenosylhomocystein). SAH je potencion├íln├ş inhibitor methyltransfer├íz. Cel├í kask├ída reakc├ş spojen├í s methionin synt├ízou a p┼Ö├şpadn├Żm nedostatkem kobalaminu m├í ve sv├ęm d┼»sledku dopad na poruchy v centr├íln├şm nervov├ęm syst├ęmu. Inhibice methionin synt├ízy, ke kter├ę dojde p┼Öi deficitu methylkobalaminu, vede k akumulaci SAH. S nar┼»staj├şc├şm SAH, nedostate─Źnou metylac├ş protein┼», doch├íz├ş k po┼íkozen├ş CNS (centr├íln├şho nervov├ęho syst├ęmu). Nap┼Ö├şklad chyb─Ťj├şc├ş metylace argininu v pozici 107 alkalick├ęho myelinu vede k destabilizaci b├şlkovin a rozvoji neuropatie. Nedostatek kobalaminu s n├ísledn├Żm deficitem v deoxyribonukleotidech vede k poruch├ím v hematopo├ęze. Deoxyribonukleotidy vznikaj├ş redukc├ş pat┼Öi─Źn├Żch ribonukleotid┼» v pozici C2. Reakce je katalyzov├ína ribonukleotid redukt├ízou, jej├ş┼ż sou─Ź├íst├ş jako kofaktor je 5┬┤deoxyadenosylkobalamin. Ve tk├ín├şch s velk├Żm metabolick├Żm obratem, rychlou tvorbou bun─Ťk, jako je kostn├ş d┼Öen, doch├íz├ş nejd┼Ö├şve k projev┼»m deficitu deoxyribonukleotid┼», poru┼íe synt├ęzy DNA. Projevem je pak neefektivn├ş hematopo├ęza a porucha vyzr├ív├ín├ş bun─Ťk. Dal┼í├şm dopadem deficitu kobalaminu je vysok├Ż HC (homocystein), kter├Ż je nez├ívisl├Żm faktorem rozvoje ateroskler├│zy.
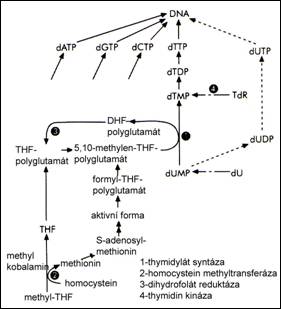
Sch├ęma upraven├ę (zdroj: Lothar Thomas, Clinical Laboratory Diagnostics, 1st. English Edition, TH-Books, Germany 1998, str. 435)
Zdroj (synt├ęza, p┼Ö├şjem)
Vitamin B12 je rozpustn├Ż ve vod─Ť, je syntetizov├ín mikroorganismy i jin├Żmi ┼żivo─Źichy nejen ─Źlov─Ťkem. Pro metabolismus tuk┼» a aminokyselin jsou v├Żznamn├ę dva kobalamin dependentn├ş enzymy, jednak methylmalon├ít CoA mut├íza a homocystein methyltransfer├íza, p┼Öi jejich deficitu doch├íz├ş k akumulaci methylmalonov├ę kyseliny a homocysteinu v krvi.
Distribuce v organismu, obsah ve tk├ín├şch
V potrav─Ť je kobalamin obsa┼żen v mase, kde je sou─Ź├íst├ş protein┼», ze kter├Żch je po p┼»soben├ş pepsinu a gastrick├Żch kyselin uvol┼łov├ín. Zdrav├ş jedinci p┼Öijmou denn─Ť 2-6 ┬Ág kobalminu potravou. Z├ísoba v organismu zdrav├ęho jedince je v pr┼»m─Ťru 2 a┼ż 5 mg. Kobalamin obsa┼żen├Ż v potrav─Ť je p┼Öij├şm├ín ve form─Ť methylkobalaminu, hydroxykobalaminu nebo deoxyadenosylkobalaminu. Po peptick├ęm natr├íven├ş masit├ę stravy v kysel├ęm prost┼Öed├ş ┼żaludku doch├íz├ş k jeho uvoln─Ťn├ş a nav├íz├ín├ş na R-protein, produkovan├Ż slinn├Żmi ┼żl├ízami do ┼żalude─Źn├ş ┼í┼ą├ívy. Kobalamin m├í n─Ťkolika n├ísobn─Ť vy┼í┼í├ş afinitu k vazb─Ť na R-protein ne┼ż na vnit┼Ön├ş faktor. V duodenu, neutr├íln├şm pH, je R-protein natr├íven pankreatick├Żmi peptid├ízami a uvoln─Ťn├Ż kobalamin se nav├í┼że na vnit┼Ön├ş faktor a ve spole─Źn├ęm komplexu putuj├ş do ilea. Komplex se pak nav├í┼że na specifick├Ż receptor slizni─Źn├şch bun─Ťk, kobalamin je n├ísledn─Ť absorbov├ín a ─Ź├íst transportov├ína port├íln├şm ┼Öe─Źi┼ít─Ťm, ─Ź├íst je vzata na transkobalamin II, kter├Ż je syntetizov├ín endoteli├íln├şmi bu┼łkami c├ęv. Nejv─Ťt┼í├ş d├şl vitaminu je pou┼żit k synt├ęze transkobalamin I a III granulocyt├írn├şmi bu┼łkami. P┼Öes to bu┼łky tk├ín├ş jsou schopny vyu┼ż├şt kobalamin jen ve form─Ť transkobalamin II. V nich je kobalamin transformov├ín do dvou ├║─Źinn├Żch forem a to je methyl-kobalamin a adenosyl-kobalamin. Kobalamin, kter├Ż se cestou vena portae dostane do ┼żlu─Źe, pak putuje op─Ťt do tenk├ęho st┼Öeva, nav├í┼że se na R-protein a op─Ťt podl├ęh├í dal┼í├şmu enterohepat├íln├şmu cyklu. V bu┼łk├ích tk├ín├ş je aktivn├ş forma vitaminu B12┬á pou┼żita jako kofaktory r┼»zn├Żch enzym┼».
Zp┼»sob vylu─Źov├ín├ş nebo metabolismus
Laboratorn─Ť se d├í prok├ízat deficit vitaminu B12 stanoven├şm p┼Ö├şm├ę koncentrace v krvi nebo erytrocytech, pop┼Ö├şpad─Ť jako n├ísledek deficitu dependentn├şch enzym┼» stanovit koncentraci kyseliny methylmalonov├ę ─Źi homocysteinu v plazm─Ť. V p┼Ö├şpad─Ť prok├ízan├ęho deficitu B12 je vhodn├ę doplnit kobalamin absorp─Źn├ş test pro objasn─Ťn├ş p┼Ö├ş─Źiny (Schilling┼»v test).
Biologick├Ż polo─Źas
Kontroln├ş (┼Ö├şd├şc├ş) mechanismy
Literatura
Lothar Thomas, Clinical Laboratory Diagnostics, 1st. English Edition, TH-Books, Germany 1998
Poznámky
Appendixy
Autorsk├ę pozn├ímky
Vladim├şr Barto┼í (1998)
Jiřina Lukášková (2008)