Abstrakt
Cyklosporin A (CyA) je
cyklick├Ż polypeptid, kter├Ż p┼Öedstavuje prvn├ş p┼Ö├şrodn├ş l├ítku se selektivn├şm
imunosupresivn├şm ├║─Źinkem. Cyklosporiny jsou produkov├íny vl├íknit├Żmi p┼»dn├şmi
houbami Typocladiumum inflatum, Cylindrocarpon lucidum a dal┼í├şmi kmeny p┼»dn├şch
hub. Imunosupresivn├ş ├║─Źinek CyA byl objeven v roce 1972. V prv├Żch
letech byl pou┼ż├şv├ín p┼Öi org├ínov├Żch transplantac├şch, kde v├Żrazn─Ť zlep┼íil
p┼Öe┼ż├şv├ín├ş pacient┼» i org├ín┼», kter├ę byly pacient┼»m
transplantov├íny. V roce 1974 byl prok├íz├ín u CyA i protiz├ín─Ťtliv├Ż ├║─Źinek
p┼Öi l├ę─Źb─Ť autioimunitn├şch onemocn─Ťn├ş.
CyA je metabolizován
v j├ítrech syst├ęmem jatern├şch enzym┼» monooxid├íz cytochromu P 450.
Biotransformac├ş CyA vznik├í a┼ż n─Ťkolik des├ştek metabolit┼», kter├ę mohou m├şt jak
imunosupresivn├ş, tak toxick├ę ├║─Źinky.
Vlastn├ş CyA vykazuje krom─Ť imunosupresivn├şch vlastnost├ş i
n─Ťkter├ę toxick├ę ├║─Źinky (nefrotoxicitu, hepatotoxicitu a neurotoxicitu).
Biologick├í dostupnost CyA je nesm├şrn─Ť variabiln├ş a kol├şs├í od 5 do 70 % (pr┼»m─Ťr
30 %). Koncentrace CyA jsou proto b─Ť┼żn─Ť monitorov├íny v krvi.
Koncentrace CyA je nutno
udr┼żet v ├║zk├ęm terapeutick├ęm okn─Ť po celou dobu imunosupresivn├ş l├ę─Źby,
kter├í v p┼Ö├şpad─Ť transplantac├ş trv├í do konce ┼żivota. Monitorov├ín├ş je mo┼żn├ę
bu─Ć pomoc├ş HPLC metod nebo imunoanalytick├Żch stanoven├ş.
Terminologie
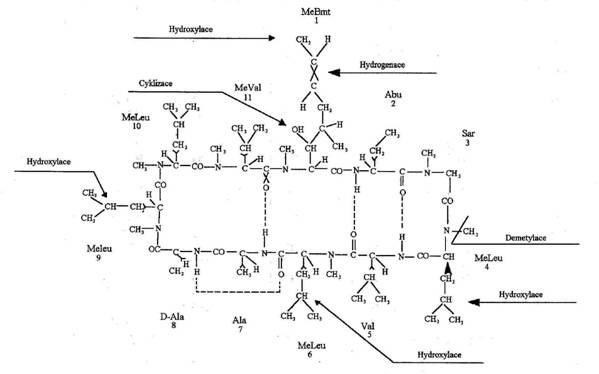
Dekapeptid:
cyclo-[MeBmt-a-Abu-Sar-MeLeu-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal],
kde
MeBmt je (2S,3R,4R,6E)-3-hydroxy-4-methyl-2-methylamino-6-octová kyselina
Synonyma
generick├Ż
název: Ciclosporinum
speciality:
Sandimmun, Consupren
jin├ę ozna─Źen├ş: CsA
Odkazy na jin├ę relevantn├ş
dokumenty, dal┼í├ş informace
Cyklosporin direct (RIA, Immunotech)
Cyklosporin (RIA, specifick├Ż, Immunotech)
Struktura
Cyklosporin A je cyklick├Ż
undekapeptid se strukturou cyclo-[MeBmt-a-Abu-Sar-MeLeu-Val-MeLeu-Ala-D-Ala-MeLeu-MeLeu-MeVal], kde MeBmt je
(2S,3R,4R,6E)-3-hydroxy-4-methyl-2-methylamino-6-octov├í kyselina. Je to b├şl├í,
krystalick├í l├ítka bez chuti a z├ípachu, s molekulovou hmotnost├ş 1201 Da. Na
rozd├şl od line├írn├şch peptid┼» cyklosporiny nemaj├ş volnou karboxy- ani amino-
skupinu a proto se nerozpou┼ít├ş ve vod─Ť, ale jsou rozpustn├ę v tuc├şch a
organick├Żch rozpou┼ít─Ťdlech. Jsou schopn├ę vystupovat jako ligandy a tvo┼Öit
komplexy s n─Ťkter├Żmi kationy. CyA je velmi st├íl├Ż a jeho cyklick├í struktura
se rozpad├í a┼ż za p┼»soben├ş siln├Żch kyselin a zv├Ż┼íen├ę teploty. V organick├Żch
rozpou┼ít─Ťdlech za p┼Ö├ştomnosti kyselin vznikaj├ş izocyklosporiny. Existuje cel├í
┼Öada reakc├ş CyA, p┼Öi n├ş┼ż doch├íz├ş k modifikaci na jednotliv├Żch
aminokyselin├ích bez otev┼Öen├ş cyklick├ęho skeletu. Komplikovanou sm─Ťs produkt┼» se
poda┼Öilo roz┼íifrovat a┼ż s pou┼żit├şm kombinace kapalinov├ę chromatografie
a hmotnostn├ş spektrometrie.
Obr├ízek 1: Struktura CyA s lokalizac├ş hlavn├şch m├şst metabolizace.
Farmakokinetika
Na hladinu CyA
v organismu maj├ş vliv r┼»zn├ę faktory. Mezi n─Ť pat┼Ö├ş hlavn─Ť p┼Ö├şjem potravy,
stav org├ín┼», zm─Ťna vst┼Öeb├ív├ín├ş v gastrointestin├íln├şm traktu, porucha vst┼Öeb├ív├ín├ş
lipid┼», v─Ťk, jatern├ş onemocn─Ťn├ş, vy┼í┼í├ş hladiny kreatininu a interakce
s ostatn├şmi l├ęky. K t─Ťmto faktor┼»m se ┼Öad├ş i genetick├ę faktory, jako
je nap┼Ö. polymorfismus cytochromu P-450. Absorpce CyA nen├ş ├║pln├í a vyzna─Źuje se
v├Żznamnou intra- a interindividu├íln├ş variabilitou.
Rozd├şln├í biologick├ę
dostupnost, clearence a d├ívka CyA p┼Öin├í┼í├ş ┼íirok├ę rozmez├ş koncentrac├ş CyA
v krvi u jednotliv├Żch pacient┼», kter├ę mohou m├şt za n├ísledek rozd├şlnou
odpov─Ť─Ć na terapii. Krom─Ť toho po operaci je ─Źasto nedostate─Źn├í nebo variabiln├ş
absorpce CyA a monitorov├ín├ş jeho koncentrace je efektivn├ş prost┼Öedek, jak
p┼Öedej├şt v─Ťt┼íin─Ť negativn├şch d┼»sledk┼». Sledov├ín├ş koncentrace CyA hraje
d┼»le┼żitou roli i v monitorov├ín├ş compliance pacient┼» a v sledov├ín├ş
interakc├ş s ostatn├şmi l├ęky.
Pro optim├íln├ş d├ívkov├ín├ş CyA,
zejm├ęna p┼Öi org├ínov├Żch transplantac├şch, se strategie TDM (Terapeutic Drug
Monitoring) n─Ťkolikr├ít revidovala. V─Ťt┼íina transplanta─Źn├şch center pou┼ż├şv├í
odb─Ťr vzork┼» pro anal├Żzu CyA v ├║doln├şch koncentrac├şch (through level), to
je p┼Öed pod├ín├şm dal┼í├ş d├ívky l├ęku. Po zaveden├ş mikroemulzn├ş formy CyA, se znovu
diskutovala ot├ízka vhodnosti takov├ęhoto ─Źasov├ín├ş odb─Ťr┼» pro TDM. Bylo
prok├íz├íno, ┼że tot├íln├ş expozice CyA, vyj├íd┼Öen├í jako AUC (Area Under the Curve)
je lep┼í├şm parametrem pro TDM a tak├ę l├ępe koreluje s klinick├Żm stavem, ne┼ż
koncentrace nam─Ť┼Öen├ę p┼Öed pod├ín├şm n├ísleduj├şc├ş d├ívky. Dal┼í├ş studie potvrdily, ┼że
AUC se d├í stanovit s dostate─Źnou p┼Öesnost├ş i p┼Öi omezen├ęm po─Źtu odb─Ťr┼»
(sparse sampling). CyA se obvykle m─Ť┼Ö├ş v intervalu 0-6 hodin po pod├ín├ş, nej─Źast─Ťji
v nult├ę, prvn├ş, druh├ę nebo t┼Öet├ş hodin─Ť. N─Ťkter├í centra v┼íak po─Ź├ştaj├ş AUC
i z v─Ťt┼í├şho po─Źtu odb─Ťr┼» a┼ż po 12-ti hodinov├Ż interval.
V klinick├ę praxi je CyA
pou┼ż├şv├ín zejm├ęna peror├íln─Ť. V ─îesk├ę republice jsou zaregistrov├íny n├ísleduj├şc├ş p┼Ö├şpravky:
Mikroemulgovan├ę kapsle, specialita Consupren o s├şle 25, 50, 100 mg (Galena,
─îR), Sandimmun Neoral 25, 50, 100 mg (Sandoz, ┼áv├Żcarsko) a Sandimmun Neoral 10
mg (Novartis, ┼áv├Żcarsko). Z roztok┼» jsou to Consupren a Sandimmun Neoral
v koncentraci 100 mg/ml. Pro parenter├íln├ş pou┼żit├ş (jako infuze) se
pou┼ż├şvaj├ş 5 ml injekce s koncentrac├ş 50 mg/ml.
Na rozd├şl od jin├Żch
peptidick├Żch l├ę─Źiv je CyA p┼Öi peror├íln├şm pod├ín├ş dostate─Źn─Ť stabiln├ş.
V kysel├ęm prost┼Öed├ş ┼żaludku m┼»┼że podl├ęhat reverzibiln├ş konverzi na
izocyklosporin A jen asi 2 % CyA. Mno┼żstv├ş absorbovan├ęho l├ę─Źiva je z├ívisl├ę na
celkov├ęm podan├ęm mno┼żstv├ş l├ę─Źiva a na rychlosti, s jakou se l├ę─Źivo
uvol┼łuje z l├ękov├ę formy. Pro farmakokinetiku CyA je charakteristick├í
v├Żrazn├í variabilita biologick├ę dostupnosti, kter├í je u zdrav├Żch dobrovoln├şk┼»
pr┼»m─Ťrn─Ť 30 % (od 5 do 70 %). CyA je absorbov├ín p┼Öedev┼í├şm v tenk├ęm st┼Öev─Ť,
proto je d├ęlka tenk├ęho st┼Öeva d┼»le┼żit├Ż faktor absorpce a s t├şm souvis├ş
tak├ę pot┼Öeba v─Ťt┼í├ş d├ívky CyA u d─Ťt├ş. Variabilita biologick├ę dostupnosti CyA
m┼»┼że b├Żt zp┼»sobena zhor┼íenou absorpc├ş. Koncentrace CyA po peror├íln├şm pod├ín├ş
dosahuje vrcholu u v─Ťt┼íiny pacient┼» za dobu 1-2 hodiny po pod├ín├ş mikroemulzn├ş
formy.
CyA je prim├írn─Ť vylu─Źov├ín
┼żlu─Ź├ş. Pouze 6 % z peror├íln├ş aplikace se vylu─Źuje mo─Ź├ş, p┼Öi─Źem┼ż pouze 0,1
% je vylou─Źeno v nezm─Ťn─Ťn├ę form─Ť. Jeho elimina─Źn├ş polo─Źas je 6ÔÇô20
hodin, pr┼»m─Ťr 10 hodin. N─Ťkter├ę farmakokinetick├ę parametry jsou uvedeny
v tabulce.
Tabulka ─Ź. 1. Z├íkladn├ş farmakokinetick├ę
parametry cyklosporinu A
|
Charakteristika |
Cyklosporin A |
|
─îas maxim├íln├ş
koncentrace po pod├ín├ş d├ívky (Tmax) |
1-8 hodin |
|
Biologická dostupnost
(F) |
2-89 % (pr┼»m─Ťr: 30 %) |
|
Distribu─Źn├ş objem (Vd) |
0,9-4,8 l/kg (pr┼»m─Ťr:
3,5 l/kg) |
|
Clearance (Cl) |
2,0-11,8 ml/min/kg
(pr┼»m─Ťr: 4,5 ml/min/kg) |
|
Polo─Źas eliminace (t1/2) |
6-20 hodin (pr┼»m─Ťr:
10 hodin) |
|
CyA v├ízan├Ż na krevn├ş
bu┼łky |
60 % |
|
CyA v├ízan├Ż na
plazmatick├ę lipoproteiny |
85-90 % |
Distribu─Źn├ş objem
Distribu─Źn├ş
objem se pohybuje od 0,9 do 4,8 l/kg s pr┼»m─Ťrem 3,5 l/kg.
Biologick├Ż polo─Źas
Biologick├Ż polo─Źas CyA je
mezi
Vazba na proteiny
CyA v organismu
cirkuluje v krvi v├íz├ín na bun─Ť─Źn├ę membr├íny krvinek nebo na plazmatick├ę
lipoproteiny. V erytrocytech se v├í┼że 41-58 % CyA, 4-9 %
v lymfocytech a v plazm─Ť se nach├íz├ş CyA v 33-47 % (z 90 % je v├íz├ín na
lipoproteiny). V plazm─Ť se nam─Ť┼Ö├ş jen zhruba 40 % obsahu CyA
v syst├ęmov├ę cirkulaci.
Vzhledem i k teplotn─Ť
z├ívisl├ę distribuci CyA mezi krevn├ş elementy a lipofiln├ş ─Ź├ístice s├ęra, se podle
doporu─Źen├ş z Lake Louise z roku 1995 jednozna─Źn─Ť u┼ż├şv├í pro TDM pln├í
nesr├í┼żliv├í krev s p┼Ö├şdavkem
EDTA (1ÔÇô2 mg/ml krve) s n├íslednou
extrakc├ş CyA, obvykle metanolem.
Zp┼»sob vylu─Źov├ín├ş nebo
metabolismu
CyA je prvn├ş p┼Ö├şrodn├ş
l├ítka se selektivn├şm imunosupresivn├şm ├║─Źinkem na lymfoidn├ş bu┼łky a to zejm├ęna
na T lymfocyty. Z p┼Ö├şrodn├şch cyklosporin┼» vykazuj├ş imunosupresivn├ş
├║─Źinek cyklosporin A, C, D, G a M. Jednotliv├ę cyklosporiny se li┼í├ş pouze
v jedn├ę aminokyselin─Ť. Nejv─Ťt┼í├ş imunosupresivn├ş a protiz├ín─Ťtliv├Ż ├║─Źinek m├í
však CyA (CyA>CyD>CyC).
CyA je indikován
k potla─Źen├ş patologick├ę imunitn├ş reakce p┼Öi autoimunitn├şch chorob├ích,
k inhibici norm├íln├ş imunitn├ş reakce p┼Öi transplantac├şch org├ín┼» a
k profylaxi rejekc├ş u transplantac├ş kostn├ş d┼Öen─Ť. CyA m├í lep┼í├ş specifick├ę
├║─Źinky ne┼ż jin├í imunosupresiva. Zasahuje specificky do imunitn├şho syst├ęmu, kde
tlum├ş tvorbu cytotoxick├Żch T lymfocyt┼».
Imunosupresivn├ş ├║─Źinek CyA
spo─Ź├şv├í ve schopnosti inhibovat metabolick├ę dr├íhy zapojen├ę do p┼Öenosu sign├ílu
z receptor┼» T lymfocyt┼» do j├ídra a t├şm blokovat ─Źasnou aktivaci gen┼» pro
synt├ęzu lymfokin┼» na ├║rovni transkripce. CyA se v├í┼że na T lymfocyty
nespecificky fyzik├íln─Ť-chemickou interakc├ş s lipidy v bun─Ť─Źn├ę
membr├ín─Ť. CyA interaguje nespecificky s libovoln├Żm povrchem, ale
specificky ovliv┼łuje pouze funkci T lymfocyt┼». Jeho imunosupresivn├ş ├║─Źinek je
zprost┼Öedkov├ín intracelul├írn├şm vazebn├Żm proteinem cyklofilinem, kter├Ż vykazuje
enzymatickou aktivitu peptidyl-propyl izomerázy. Komplex CyA-cyklofilin
selektivn─Ť inhibuje calcineurin, co┼ż je enzym se serin-threonin
fosfat├ízovou aktivitou s nezbytnou spolu├║─Źast├ş Ca+2 iont┼».
Inhibic├ş t├ęto fosfat├ízy v aktivovan├Żch T lymfocytech je podstatn─Ť
redukov├ína translokace cytoplasmatick├ę subjednotky NFAT (nuclear
faktor of activated T lymfocytes) do jadern├ęho kompartmentu s n├ísledn├Żm
naru┼íen├şm transkripce genu pro interleukin-
L├ę─Źba CyA je spojena
s v├í┼żn├Żmi toxick├Żmi vedlej┼í├şmi ├║─Źinky. Prim├írn─Ť se jedn├í o nefrotoxicitu a
hepatotoxicitu, popisována je i neurotoxicita.
Aktivn├ş metabolity
Cyklosporiny jsou
metabolizov├íny enzymatick├Żm syst├ęmem monooxygen├íz, katalyzovan├Żch jatern├şm
cytochromem P-450, p┼Öi─Źem┼ż z┼»st├ív├í zachov├ína jejich cyklick├í struktura. Na
metabolizaci CyA se v nejv─Ťt┼í├ş m├ş┼Öe pod├şl├ş nejd┼»le┼żit─Ťj┼í├ş ─Źlen podjednotky
P-450 3A, P-450 3A4. Celkov─Ť je dnes zn├ímo asi 30 metabolit┼» CyA.
Nejv├Żznamn─Ťj┼í├şmi a nejv├şce prostudovan├Żmi metabolity z hlediska toxicity a
klinick├ęho ├║─Źinku jsou metabolity AM1 (M17), AM4N (M21) a AM9 (M1).
Clearance
Clearence
CyA (z krve) se pohybuje od 5 ÔÇô 7 ml/min/kg u dosp─Ťl├Żch po transplantaci jater
a ledvin u dosp─Ťl├Żch a od 8 do 10 ml/min./kg u pacient┼» po transplantaci kostn├ş
d┼Öen─Ť. Prim├írn├ş elimina─Źn├ş cestou CyA je exkrece ┼żlu─Ź├ş. Jen velmi mal├ę mno┼żstv├ş
0,1 a┼ż 6 % podan├ę d├ívky se vylu─Źuje ledvinami. CyA p┼Öech├íz├ş do mate┼Ösk├ęho
ml├ęka.
Interakce s jin├Żmi l├ęky ovliv┼łuj├şc├şmi biologickou dostupnost
Proto┼że
CyA je intenzivn─Ť metabolizov├ín cytochromem P-450 3A4, a ten se pod├şl├ş na
metabolismu v├şce ne┼ż 50 % v┼íech l├ęk┼», jsou interakce jednotliv├Żch l├ęk┼»
v├Żznamn├ę. L├ęky na b├ízi fenytoinu, fenobarbit├ílu, valproov├ę kyseliny,
karbamazepinu,a rifampicinu indukuj├ş syst├ęm cytochromu P-450, jestli┼że jsou
pod├ív├íny soub─Ť┼żn─Ť s CyA, zvy┼íuj├ş metabolismus CyA a tedy sni┼żuj├ş
koncentrace CyA v syst├ęmov├ę cirkulaci.
Na druh├ę stran─Ť l├ęky na b├ízi
ketokonazolu, erytromycinu, varapamilu a diltiazenu inhibuj├ş cytochrom P-450,
sni┼żuj├ş metabolismus CyA a takto zvy┼íuj├ş koncentrace CyA v syst├ęmov├ę
cirkulaci.
Literatura
Holt D. W., Johnston A.,
Roberts N. B., Tredger J. M. and Trull A. K. (1994) Methodological and
clinical aspects of cyclosporin monitoring report of the Association of
Clinical Biochemists task force. Ann Clin Biochem. 31: 424-427
Oellerich M., Armstront
V.W., Kahan B., Shaw L., Holt D.W., Yatscoff R. et al.: Lake Louise consensus
conference on cyclosporin monitoring in organ transplantation: report of the consensus
panel. Ther Drug Monit 17, (1995), 642-654
Ma┼ąha V. a kol. (1994)
Cyklosporin A. Grada Publishing.
Poznámky
CyA se pou┼ż├şv├í
p┼Öi imunosupresivn├ş l├ę─Źb─Ť u pacient┼» s transplantov\n├Żmi org├íny, ale
i u autoimunitn├şch nemoc├ş v─Ťt┼íinou v kombinaci s jin├Żmi l├ęky a
imunosupresivy (azathioprin, kortikoidy, mofetylester kyseliny mykofenolov├ę,
tacrolimus, antithymocyt├írn├ş a antilymfocyt├írn├ş protil├ítky).
├Üzk├ę terapeutick├ę rozmez├ş a
velk├í interindividu├íln├ş variabilita farmakokinetiky CyA vy┼żaduje rutinn├ş
monitorov├ín├ş jeho koncentrac├ş v krvi. V sou─Źasn├ę dob─Ť se pou┼ż├şv├í pro
monitorov├ín├ş CyA n─Ťkolik metod, kter├ę zahrnuj├ş stanoven├ş pomoc├ş vysoko├║─Źinn├ę
kapalinov├ę chromatografie (HPLC) a r┼»zn├ę druhy imunoanalytick├Żch metod jako je
klasick├í radioimunoanal├Żza (RIA) nebo n─Ťkter├ę formy automatizovan├Żch
neizotopov├Żch variant imunoanal├Żzy, p┼Öedev┼í├şm enzymoimunonanal├Żzy: FPIA ÔÇô
ÔÇťfluorescence polarization imunoassayÔÇŁ, EMIT ÔÇô ÔÇťenzymeÔÇômultiplied immunoassay
techniquesÔÇŁ a CEDIA ÔÇô ÔÇťcloned enzyme-donor immunoassayÔÇŁ. Standardn├ş metodou je
dob┼Öe validovan├í HPLC metoda stanoven├ş CyA. Tyto metody jsou v┼íak pom─Ťrn─Ť drah├ę a
─Źasov─Ť velmi n├íro─Źn├ę, proto se ─Źast─Ťji pou┼ż├şvaj├ş imunoanalytick├ę metody. Obecn─Ť
lze ┼Ö├şci, ┼że v┼íechny imunoanalytick├ę metody nadhodnocuj├ş v├Żsledky koncentrac├ş
CyA v d┼»sledku zk┼Ö├ş┼żen├Żch reakc├ş s jednotliv├Żmi metabolity CyA, kter├ę
jsou p┼Ö├ştomny v krvi.
Mezi doporu─Źen├şmi
publikovan├Żmi v materi├ílech z konference v Lake Louise
v roce 1995 byla uvedena kriteria, kter├ę mus├ş spl┼łovat metoda, aby mohla
b├Żt pou┼żita pro TDM CyA u pacient┼» l├ę─Źen├Żch CyA. Pro reprodukovatelnost: £10 % p┼Öi koncentraci 50 mg/l a
£5 % p┼Öi koncentraci 300 mg/l. Pro spr├ívnost pak bylo publikov├íno kriterium pro
srovn├ín├ş s validovanou HPLC metodou. Sm─Ťrnice korelace metod se mus├ş
pohybovat v intervalu 0,9ÔÇô1,1 a intercept od ÔÇô15 mg/l do +15 mg/l, Sy/x £15 mg/l.
V─Ťt┼íina center v sou─Źasn├ę dob─Ť pou┼ż├şv├í relativn─Ť specifick├ę
imunoanalytick├ę metody stanoven├ş CyA. Zat├şmco radioizotopov├ę metody jsou
v├şcem├ęn─Ť na ├║stupu, p┼Öib├Żv├í zejm├ęna automatizovan├Żch imunoanalytick├Żch metod.
V tabulce ─Ź. 2 jsou uvedena
terapeutick├í rozmez├ş CyA pro monitorov├ín├ş p┼Öi transplantaci ledvin, srdce a
jater tak, jak byly ur─Źeny pro jednotliv├ę metody p┼Öi pod├ív├ín├ş inici├íln├ş i
udr┼żovac├ş d├ívky, podle konsenzu├íln├şho doporu─Źen├ş.
Tabulka ─Ź. 2: Doporu─Źen├ę
terapeutick├ę rozmez├ş koncentrac├ş cyklosporinu A (├║doln├ş koncentrace) u
jednotliv├Żch transplantovan├Żch org├ín┼».
|
Metoda |
Ledviny |
Srdce |
Játra |
|
|
trojkombinace |
trojkombinace |
trojkombinace |
dvojkombinace |
|
|
Inici├íln├ş d├ívka |
[mg/l] |
[mg/l] |
[mg/l] |
[mg/l] |
|
HPLC |
150-225 |
250-325 |
225-300 |
|
|
FPIA |
250-375 |
300-400 |
250-313 |
300-375 |
|
I-RIA |
160-200 |
250-325 |
250-300 |
|
|
EMIT |
125-200 |
275-375 |
|
125-200 |
|
Udr┼żovac├ş d├ívka |
[mg/l] |
[mg/l] |
[mg/l] |
[mg/l] |
|
HPLC |
100-150 |
125-175 |
100-150 |
100-150 |
|
FPIA |
100-250 |
150-250 |
135-200 |
150-250 |
|
I-RIA |
75-150 |
90-160 |
150-238 |
|
|
EMIT |
75-150 |
150-250 |
|
|
Autorsk├ę pozn├ímky
Kristian ┼áafar─Ź├şk