Abstrakt
Pr┼»tokov├í cytometrie je metoda, kter├í umo┼ż┼łuje simult├ínn├ş
m─Ť┼Öen├ş a anal├Żzu fyzik├íln─Ť-chemick├Żch vlastnost├ş bu┼łky nebo jin├Żch biologick├Żch
─Ź├ístic b─Ťhem jejich pr┼»chodu laserov├Żm paprskem.
Souvisej├şc├ş informace
Text
Průtoková
cytometrie je metoda, kter├í umo┼ż┼łuje simult├ínn├ş m─Ť┼Öen├ş a anal├Żzu
fyzik├íln├şch-chemick├Żch vlastnost├ş bu┼łky nebo jin├Żch biologick├Żch ─Ź├ístic b─Ťhem
jejich pr┼»chodu laserov├Żm paprskem. Ve chv├şli, kdy bu┼łka tento paprsek k┼Ö├ş┼ż├ş
doch├íz├ş k lomu a rozptylu┬á sv─Ťtla,
kter├Ż podle sm─Ťru a ├║hlu lomu b├Żv├í ozna─Źov├ín jako p┼Ö├şm├Ż rozptyl - forward
scatter (FSC) a bo─Źn├ş rozptyl - side scatter (SSC). FSC je charakterizov├ín
lomem sv─Ťtla o mal├ęm ├║hlu ( 2o-13o ) a je ├║m─Ťrn├Ż
velikosti bu┼łky. ├Ühel bo─Źn├şho┬á rozptylu
(SSC) je 900 a je indik├ítorem vnit┼Ön├ş bun─Ť─Źn├ę struktury resp.
granularity. Krom─Ť parametr┼» lomu a rozptylu sv─Ťtla je detekov├ína rovn─Ť┼ż
fluorescence proch├ízej├şc├şch bun─Ťk nebo ─Ź├ístic. Fluorescen─Źn├ş barviva
(fluorochromy) nav├ízan├ę na analyzovan├ę bu┼łky nebo ─Ź├ístice absorbuj├ş sv─Ťtlo
ur─Źit├ę vlnov├ę d├ęlky vyza┼Öovan├ę laserem┬á a
n├ísledn─Ť vyza┼Öuj├ş (emituj├ş) ─Ź├íst takto absorbovan├ęho sv─Ťtla av┼íak ji┼ż o odli┼ín├ę
vlnov├ę d├ęlce. V pr┼»tokov├ę cytometrii se pou┼ż├şvaj├ş fluorochromy, kter├ę maj├ş
v─Ťt┼íinou stejn├ę spektrum absorp─Źn├ş, ale jin├ę emisn├ş. Pr┼»tokov├ę cytometry
vyu┼ż├şvaj├ş jako sv─Ťteln├ęho zdroje toti┼ż nej─Źast─Ťji argonov├Ż laser o excita─Źn├ş
vlnov├ę d├ęlce 488 nm.
Vlastn├ş
analytick├í za┼Ö├şzen├ş se naz├Żvaj├ş pr┼»tokov├ę cytometry a skl├ídaj├ş se ze syst├ęmu
fluidn├şho, optick├ęho a elektronick├ęho. Pomoc├ş fluidn├şho syst├ęmu jsou bu┼łky
obaleny pl├í┼ít─Ťm nosn├ę tekutiny (PBS, komer─Źn├ş tekutiny jako FACSFlow, Bioton,
Unisol) a pod tlakem hnány do 
speci├íln├şho prostoru (flow chamber), kde doch├íz├ş┬á ke k┼Ö├ş┼żen├ş dr├íhy paprsku monochromatick├ęho
laseru┬á proch├ízej├şc├şho bu┼łkou .
Optick├Ż
syst├ęm sest├ív├í┬á z ─Ź├ísti excita─Źn├ş
tvo┼Öen├ę laserem a soustavou ─Źo─Źek a hranol┼» usm─Ťr┼łuj├şc├şch sv─Ťteln├Ż paprsek a
─Ź├ísti sb─Ťrn├ę. Sb─Ťrn├í ─Ź├íst optiky se sest├ív├í z optick├Żch zrcadel a filtr┼»
umo┼ż┼łuj├şc├şch detekci sv─Ťteln├Żch kvant specifick├ę vlnov├ę d├ęlky p┼Ö├şslu┼ín├Żmi
optick├Żmi detektory.
Syst├ęm
elektronick├Ż pak p┼Öev├íd├ş optick├Ż sign├íl na elektrick├Ż a z├írove┼ł jej
digitalizuje pro po─Ź├şta─Źovou anal├Żzu. Data v┼íech parametr┼» m─Ť┼Öen├Żch na
individu├íln├ş┬á bu┼łce jsou shrom├í┼żd─Ťna a
uchov├ína jako datov├Ż soubor, tzv. ÔÇťlist mode fileÔÇŁ,┬á kter├Ż je p┼Öipraven k n├ísledn├ę anal├Żze.
Zobrazen├ş dat m┼»┼że b├Żt provedeno mnoha zp┼»soby, nej─Źast─Ťj┼í├ş je tzv. ÔÇťdot plotÔÇŁ,
co┼ż je dvourozm─Ťrn├Ż graf, ve kter├ęm je ka┼żd├í bu┼łka zobrazena jako te─Źka.
V├Żsledn├í data mohou b├Żt rovn─Ť┼ż zobrazena v trojrozm─Ťrn├ęm izometrick├ęm
grafu nebo ve form─Ť histogramu pro ka┼żd├Ż jednotliv├Ż parametr. V├Żrazn├Żm p┼Ö├şnosem
t├ęto technologie je multiparametrick├í┬á
anal├Żza, kter├í umo┼żn├ş v├Żb─Ťr r┼»zn├Żch bun─Ť─Źn├Żch populac├ş s r┼»zn├Żmi
vlastnostmi a jejich vzájemnou kombinaci.
Pr┼»tokov├ę
cytometry jsou b─Ť┼żn─Ť vybaveny dv─Ťma a┼ż t┼Öemi detektory, kter├ę m─Ť┼Ö├ş sv─Ťtlo
specifick├ę vlnov├ę d├ęlky emitovan├ę bu┼łkou.┬á
Nej─Źast─Ťj┼í├şmi fluorochromy u┼ż├şvan├Żmi v pr┼»tokov├ę cytometrii se
spole─Źnou excita─Źn├ş vlnovou d├ęlkou 488 nm jsou fluorescein izothiokyan├ít
(FITC), kter├Ż emituje p┼Öi 530 nm , phycoerytrin (PE) s emis├ş p┼Öi 530 nm ,
peridin-chlorophyl (PerCP)┬á s emis├ş p┼Öi
675 nm, Phycoerythrin-Cy5 (PE-Cy5) s emis├ş p┼Öi 667┬á nm nebo Texas red s emis├ş p┼Öi 615 nm.
V─Ťt┼íina t─Ťchto fluorochrom┼» b├Żv├í konjugov├ína s r┼»zn├Żmi protil├ítkami a
u┼ż├şv├ína sou─Źasn─Ť pro v├şcebarevnou anal├Żzu.
V sou─Źasn├ę
dob─Ť za─Ź├şn├í po─Źet fluorochrom┼» a tud├ş┼ż i parametr┼» v multiparametrov├ę
anal├Żze v├Żrazn─Ť stoupat, co┼ż vy┼żaduje p┼Ö├ştomnost druh├ęho event. dal┼í├şch┬á sv─Ťteln├Żch zdroj┼» odli┼ín├ę excita─Źn├ş vlnov├ę
d├ęlky. Jako druh├Ż laser je vyu┼ż├şv├ín p┼Öedev┼í├şm┬á
helium-neonov├Ż laser nebo laser-dioda o vlnov├ę d├ęlce 663 nm.
Z fluorochrom┼» u┼ż├şvan├Żch pro tyto aplikace m┼»┼żeme zm├şnit nap┼Ö.
Allophycocyanin (APC) s emis├ş p┼Öi 660 nm, APC-Cy5 s emis├ş p┼Öi 767 nm
a iododicarboxycyanin (Cy5) s emis├ş p┼Öi 667 nm.┬á┬á P┼Ö├şstroje vybaven├ę dal┼í├şm sv─Ťteln├Żm zdrojem
umo┼ż┼łuj├ş ─Źty┼Ö, p─Ťti a v├şcen├ísobnou barevnou anal├Żzu a slou┼ż├ş zejm├ęna
k identifikaci unik├ítn├şch bun─Ť─Źn├Żch populac├ş nebo simult├ínn├ş detekci
v─Ťt┼í├şho po─Źtu bun─Ť─Źn├Żch znak┼» resp. charakteristik.
Pro
spr├ívn├ę┬á nastaven├ş neboli kalibraci
p┼Ö├şstroje se u┼ż├şv├í speci├íln├şch mikrokuli─Źek nesouc├şch na sv├ęm povrchu r┼»zn├ę
fluorochromy. B─Ťhem procesu kalibrace doch├íz├ş jednak k optimalizaci
sign├ílu parametr┼» lomu a rozptylu sv─Ťtla┬á
a jednak kompenzaci jednotliv├Żch fluorochrom┼». ┼śada fluorochrom┼»
u┼ż├şvan├Żch v pr┼»tokov├ę cytometrii se toti┼ż ve sv├Żch emisn├şch spektrech do
ur─Źit├ę m├şry p┼Öekr├Żv├í. Pomoc├ş speci├íln├şho nastaven├ş optick├Żch filtr┼» lze a je
zapot┼Öeb├ş vz├íjemn├Ż p┼Öekryv t─Ťchto sign├íl┼» v├Żrazn─Ť eliminovat.
Speci├íln├ş
aplikac├ş pr┼»tokov├ę cytometrie je bun─Ť─Źn├ę t┼Ö├şd─Ťn├ş (cell sorting). Jedn├í se o
kombinaci analytick├Żch postup┼» pr┼»tokov├ę cytometrie se schopnost├ş t┼Ö├şdit bu┼łky
na z├íklad─Ť p┼Öedem zn├ím├Żch parametr┼». B─Ťhem procesu t┼Ö├şd─Ťn├ş jsou bu┼łky emituj├şc├ş
┼ż├ídan├Ż fluorecen─Źn├ş sign├íl elektricky nabity ve vysokonap─Ť┼ąov├ęm elektrick├ęm
poli mezi speci├íln├şmi tzv. vychylovac├şmi desti─Źkami a pot├ę t┼Ö├şd─Ťny do sb─Ťrn├Żch
zkumavek.
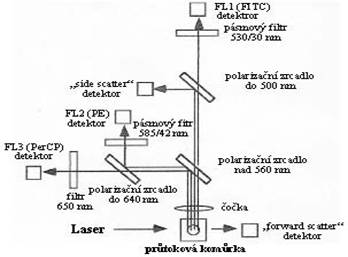
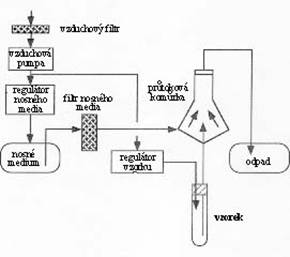 Sch├ęma fluidn├ş ─Ź├ísti pr┼»tokov├ęho
cytometru┬á┬á┬á┬á┬á┬á┬á Sch├ęma optick├ę ─Ź├ísti pr┼»tokov├ęho
cytometru
Sch├ęma fluidn├ş ─Ź├ísti pr┼»tokov├ęho
cytometru┬á┬á┬á┬á┬á┬á┬á Sch├ęma optick├ę ─Ź├ísti pr┼»tokov├ęho
cytometru
Literatura
- Ormerod
M.G.: Flow Cytometry. Second Edition, IRL Press, Oxford, New York, Tokyo,
1994
- Shapiro
H.M.: Practical Flow Cytometry, Third Edition, Willey-Liss, New York-Chichester-.Brisbane-Toronto-Singapore,
1995
OSN-SAutorsk├ę pozn├ímky