Centrální dogma
molekulární biologie deklaruje, že genetická informace je zakódována
v dvojité spirále - dvoušroubovicové molekule DNA. Informace je v DNA
zakódována v posloupnosti (sekvenci) nukleotidů, jejichž součástí jsou
dusíkaté báze (purinové – adenin, A, guanin, G, pyrimidinové – cytosin, C a
thymin, T). Komplementárním párováním bází (A-T,G-C) jsou oba řetězce DNA spolu
spojeny.
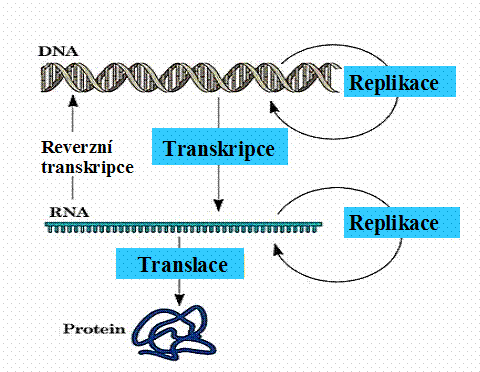
Při buněčném dělení, před rozdělením buňky se DNA replikuje a genetická informace je
předávána dceřinným buňkám dalších
buněčných generací. U některých systémů (virů) je základní genetická informace
zapsána v RNA, která se také replikuje. Je znám i proces reverzní transkripce, při
kterém se genetická informace přepisuje z RNA do DNA ( např.
v průběhu životního cyklu retrovirů).
DNA je v buňce lokalizována v chromozomech buněčného jádra a v
mimojaderné formě jako mitochondriální DNA.
V procesu transkripce je u eukaryot informace komplementárně
přepsána do hetrogenní jaderné RNA
(hnRNA), která se stává po postranskripčních úpravách - sestřihu ( vystřižení intronů), syntézy
čepičky na 5´konci RNA a poly(A) ocasu
na 3´konci), funkční mediátorovou – mRNA a přechází do cytoplasmy
aby se spojila s buněčnými ribozomy, kde probíhá translace, resp.
proteosyntéza.
Proteosyntéza
(podle: Raven P.H., Johnson G.B.: Biology, 3rd Ed., Mosby, London, 1992)
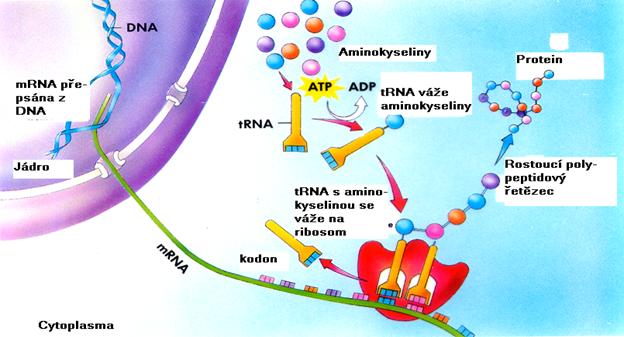
Informace mRNA je překládána z jazyku bazí do jazyka aminokyselin a
jejich sekvence v proteinu. Komplementárně
přepsaný triplet bazí do mRNA, který koduje určitou aminokyselinu se
nazývá kodon.
Soubor 64 tripletových kodonů pro 20 aminokyselin a 3 stopkodonů představuje
genetický kod. Každý kodon (kromě STOP kodonů ) v sekvenci mRNA koduje
specifickou aminokyselinu v sekvenci polypeptidu, genetický kod je
nepřekryvný. Některé aminokyseliny jsou kódovány více než jedním tripletem, což
označuje termín degenerace kódu. Pořadí tripletových kodonů v genu, jak jsou
postupně čteny a překládány od iniciačního kodonu ke stop kodonu se nazývá
čtecí rámec. Ribozomy jsou složeny ze dvou podjednotek jejichž nejpodstatnější
částí jsou 4 typy ribozomální RNA (rRNA). V ribozomu představuje mRNA
templát s kodony, na které postupně nasedají transferové RNA (tRNA)
odpovídajícími antikodony na
antikodonové kličce. Na aminoacylovém konci tRNA je navázána příslušná aminokyselina, která se
peptidickou vazbou spojí s předchozí aminokyselinou polypeptidového
řetězce. Terminační kodon translaci ukončí. Polypeptidový řetězec dále podléhá
posttranslačním úpravám tj. např. změny konformace, zkrácení nebo rozštěpení
řetězce, acetylace, glykosidace. Posttranslační úpravy jsou jedním
z mechanismů vedoucích k produkci několika proteinů z jednoho
genu.
Projekt analýzy lidského genomu měl za úkol
zmapovat lidský genom, další úsilí směřuje
k identifikaci mutací a polymorfismů.
Téměř každé onemocnění je výsledkem kombinovaného působení genů a prostředí. Podíl genetické komponenty může být
větší nebo menší.
Geneticky
podmíněná onemocnění jsou obvykle rozdělena do tří kategorií :
· monogenní
onemocnění
· chromosomální
poruchy
· multifaktoriální
onemocnění
Cytogenetika se zabývá studiem
struktury, funkce a evoluce chromosomů. Zabývá se také chováním chromosomů v
průběhu dělení zárodečných i somatických buněk. Lidská a klinická cytogenetika sleduje
především změny a nepravidelnosti procesů, které mohou vést ke
· strukturním a
· početním
odchylkám chromosomů v buněčných jádrech. Důsledkem těchto změn dochází
ke vzniku mentální retardace, mnohočetných vrozených vývojových vad,
infertility a spontánních abortů v lidské populaci.
Početní změny autosomů zahrnují například časté
trisomie chromosomů, strukturní změny autosomů jsou
nejčastěji delečními syndromy.
Početní a
strukturní změny pohlavních chromosomů (heterochromosomů, gonosomů) mohou vzniknout
během meióze nebo při následujících děleních.
Početní změny heterochromosomů jsou častější,
než změny strukturní.
Při početních změnách heterochromosomů může mít postižený jedinec
následující chromosomový komplement:
·
Chybí jeden pohlavní chromosom
(monosomie X).
·
Jeden nebo více pohlavních chromosomů je
nadpočetných (trisomie, tetrasomie, pentasomie X, nebo YY).
·
Následkem mozaicismu má postižený jedinec dvě nebo
více buněčných linií.
·
Postižený jedinec má dvě buněčné linie: 46,XX a
46,XY a jedná se o pravý chimérizmus. Ten může vzniknout velmi časnou fúzí dvou
oplozených oocytů nebo dispermií.
Frekvence
výskytu odchylek pohlavních chromosomů a autosomů
|
Výskyt odchylek
pohlavních chromosomů |
|
|
47,XYY + 47,XYY mozaika |
1:1000 |
|
47,XXY + 47,XXY mozaika |
1:900 |
|
46,XX |
1:16 000 |
|
45,X/46,XY |
1:30000 |
|
46, X inv (Y) |
1:4000 |
|
45,X + 45,X mozaika |
1:2500 |
|
47,XXX |
1:800 |
|
fraX |
1:1200 mužů, 1:2000 žen |
|
Výskyt autosomálních odchylek |
|
|
47, + 13 |
1:20000 |
|
47, + 18 |
1:6000 |
|
47, + 21 |
1:850 |
|
47, + marker chromosom |
1:5000 |
|
47, + marker, mozaika |
1:10000 |
|
delece |
1:10000 |
|
inverze |
1:8000 |
|
D/D translokace |
1:1200 |
|
D/G translokace |
1:5000 |
|
reciproké translokace |
1:1 200 |
Podle Vogel, Motulsky: Human Genetics, Springer
Verlag, Berlin - Heidelberg, 1986, str. 335.
Onkogenetika vysvětluje
genetický základ maligních onemocnění. Buněčné dělení a buněčná smrt je pod
genetickou kontrolou a jestliže somatická mutace vytvoří variantu proliferující rychleji, mutantní klon bude mít
tendenci v organismu přerůst. V procesu kancerogeneze
se uplatňují mutace zejména několika skupin genů, zejména onkogeny
a tumor supresorové geny.
Mezi maligními onemocněními převládají
sporadické neoplázie (kolem 70 %), familiární nádory (kolem
20 %) a hereditární formy nádorů (kolem 10 %).
Nejnovější molekulárně genetické technologie – microarrays, neboli
čipy však představují největší pokrok v poznání nejen kancerogeneze,
ale i v klasifikaci nádorů, prognostických parametrů a charakterizaci
jejich interindividuální variability a diferencované léčby. Čipy umožňují
sledovat mutace nebo exprese tisíců až desetitisíců genů v různých stadiích
vývoje onkogenetického procesu. Nevýhodou čipových technologií je
v současné době jejich nákladnost, některé problémy standardizace
vyhodnocování a techniky odběru tkání. Prvé výsledky jsou však více než
slibující. U karcinomu prsu se např. prokázalo, že na jeho vzniku a vývoji se
podílí kolem 300 genů. Na podkladě expresních profilů genů byly ca prsu
reklasifikovány a na rozdíl od klinické klasifikace navrženy některé specifické
terapeutické postupy.
Nádorová
cytogenetika
Většina změn, které nacházíme v nádorových buňkách jsou změny získané a
jsou klonální. Podle mezinárodně uznávané definice považujeme za klonální změnu
nález dvou mitóz se stejnou odchylkou ve smyslu chromosomové přestavby
(translokace, inverze, inzerce, amplifikace) nebo stejným nadpočetným chromosomem,
nebo tří mitóz ve kterých stejný chromosom chybí - Heim a Mitelman (1995), ISCN
(1995). Chromosomové změny v nádorových buňkách jsou získané a musíme je
odlišovat od změn konstitučních, které jsou vrozené a jsou obvykle přítomny ve všech buňkách těla.
Chromosomové odchylky v nádorových buňkách mohou být :
·
bez ztráty chromosomového materiálu ( translokace,
inverze)
·
se ztrátou chromosomového materiálu (delece určité
části chromosomu až úplná ztráta neboli monosomie)
·
se ziskem chromosomového materiálu ( amplifikace
genů až celých chromosomů)
U preleukémií a leukémií jsou známy specifické translokace, delece,
inzerce, inverze a genové amplifikace, které jsou spojené s určitým typem nebo
subtypem onemocnění a cytogenetický nález je u těchto onemocnění uznávaný jako
důležitý prognostický ukazatel. Rovněž je známo, které aneuploidie a heteroploidie, tj. změny
v počtu chromosomů, v nádorových buňkách jsou spojeny s lepší odezvou na
terapii, příznivou prognózou a delší dobou přežití nemocných. Cytogenetická
vyšetření lze využít při monitorování účinků chemoterapie a/nebo transplantace
kostní dřeně. Při indikaci cytogenetického vyšetření v klinické hematologii a
onkohematologii je vhodné spolupracovat velmi úzce se specializovanými
onkohematologickými laboratořemi, při monitorování léčby pak
s laboratořemi molekulárně-biologickými.
Od roku 1970, kdy se začaly chromosomy barvit pruhovacími technikami,
bylo u nádorů popsáno více než 1800 zlomových míst na chromosomech. Jde o
chromosomové změny, které se opakují a nejsou náhodné. Dá se proto
předpokládat, že jsou zahrnuty v procesu iniciace nádorového bujení i v progresi onemocnění. Počet
zjištěných a dále prostudovaných chromosomových odchylek u malignit se každoročně
zvyšuje a jsou známy jejich klinické a
biologické charakteristiky. Proto vznikl Atlas genetiky a cytogenetiky v
onkologii a hematologii (http://www.infobiogen.fr/services/chromcancer) jako
další volně přístupná databáze na internetu, která přináší cytogenetické a
klinické nálezy u maligních onemocnění, a je připravená pro volné použití
cytogenetiky, molekulárními genetiky a lékaři
ve všech lékařských odvětvích zainteresovaných v onkologii.
Další volně přístupné databáze jsou Katalog chromosomových aberací prof.
Mitelmana, na adrese http://cgap.nci.nih.gov/Chromosomes/Mitelman/recurrent/aberrations
a katalog
http://www.ncbi.nlm.nih.gov/CCAP
Ve všech jsou uváděny chromosomové aberace nádorových buněk. Vyšetření
solidních nádorů se v ČR provádí zatím jen velmi sporadicky a většinou k
výzkumným účelům. Rozvíjet se jako samostatná a nová laboratorní metoda začíná teprve v posledních letech u
dětských nádorů (retinoblastom, neuroblastom) a u některých nádorů mozku
(gliomy), u nádorů močového měchýře, karcinomu mammy a dalších, většinou pomocí metod molekulární
cytogenetiky.
Genetický
screening a genetické testování
Hlavním cílem genetického screeningu a genetického testování
je předejít rozvoji nemoci nebo alespoň zajistit včasnou diagnosu a léčení (genetická prevence).
Sdělení každého pozitivní výsledku genetického screeningu či genetického
testu by mělo být neoddělitelně spojeno s nabídkou genetického
poradenství, které umožní podrobné vysvětlení výsledku testu a stanovení
plánu genetické prevence nejen pro screenovaného jedince, ale i jeho rodinu.
Genetický screening a genetické testování mají následující etické
zásady:
·
genetický screening i genetické testování by mělo
být dobrovolné (s výjimkou posledního bodu)
·
genetickému screeningu i genetickému testování by
měla předcházet dostatečná informace o účelu a možných výsledcích testu a
potenciálních volbách po obdržení výsledku
·
aby se předešlo možné diskriminaci, výsledky nesmí
být sdělovány zaměstnavatelům, pojišťovatelům, výukovým institucím ani jiným
osobám bez vědomého souhlasu testovaného jedince,
·
ve vzácných případech, kdy porušení důvěrnosti
výsledku testu může být v nejlepším zájmu testovaného jedince, jiné osoby
či veřejného zdraví, by měl genetický poradce směrovat testovanou osobu ke
sdělení výsledku,
·
výsledek genetického screeningu nebo genetického
testování by měl být následován genetickým poradenstvím, zvláště je-li pro
testovaného jedince nepříznivý,
·
jsou-li známy účinné metody prevence nebo léčby,
měly by být testovanému jedinci nabídnuty bez zbytečného prodlení,
·
přináší-li genetický screening prospěch
novorozenci, měl by být povinný a bezplatný.
Prenatální
diagnostika a fetální medicína ve spolupráci s porodnictvím a lékařskou
genetikou mají nezastupitelnou úlohu v prevenci dědičných chorob a
vrozených vad a mohou zásadním způsobem ovlivnit zdravotní stav dalších
generací. Efekt této prevence je bezprostřední, závažně postižené dítě se
nemusí narodit. Mimo humánních aspektů je společensky závažný i ekonomický
přínos této prevence. Návratnost vložených prostředků u současné prenatální diagnostiky
a fetální medicíny je 20 – 50násobná a efektivita dále roste po zavedení
diagnostiky postižení plodů na úrovni analýzy DNA, která se bouřlivě již nyní
rozvíjí i u nás. Metody používané v prenatální diagnostice jsou invazivní a neinvazivní, z ostatní metod je třeba zmínit fetální terapii. Roli hrají
etické faktory.
Literatura
· Nussbaum R.L.,
McInnes R.R., Willard H.F. : Thompson & Thompson Genetics in Medicine, W.B.
Saunders, Philadelphia 2001
· Mueller F.R.,
Young I.D. : Emery´s Elements of Medical Genetics, Churchill Livingstone,
Edinburgh 2001
· Goetz P. a kol.:
Vybrané kapitoly z lékařské biologie II, Karolinum 2002
· Proposed
International Guidelines On Ethical Issues In Medical Genetics And Genetic
Services. WHO, Geneva 1997
· Mange E.J., Mange
A.P.: Basic Human Genetics. Sinauer Associates, Sunderland, 1999
· Vogel F., Motulsky
A.G.: Human Genetics. Problems and Approaches. Third, Completely Revised Edition,
1997, Springer Verlag Berlin.
· Heim S., Mitelman
F.: Cancer Cytogenetics. Second Edition, 1995, Wiley-Liss New York
· Passarge E.: Color
Atlas of Genetics, 2001, Georg Thieme Verlag.
· ISCN (1995): An
International System for Human Cytogenetic Nomenclature, Mitelman F. editor,
S.Karger, Basel, 1995
· Thompson and
Thompson: Genetics in Medicine. 2001 W.B.Saunders, Philadelphia W
Další
informace
· Klinická
genetika: základní pojmy
· Metody
molekulárně genetické
· Rejstřík
Petr Goetz, Kyra
Michalová, Ivan Šubrt, Jiří Šantavý