Abstrakt
Histidin patří mezi esenciální glukoplastické
aminokyseliny. Dva volné elektronové páry na atomech dusíku dodávají
postrannímu řetězci histidinu chelační schopnosti, takže tvoří snadno komplexy
s těžkými kovy. Dekarboxylací histidinu vzniká histamin – biogenní amin,
který má širokou škálu působení v organismu.
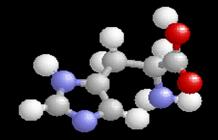
Histidin, 2-amino-1H-imidazol-4-propionát
Synonyma
2-amino-1H-imidazol-4-propionát
Klasifikační kódy
Odkazy na jiné
relevantní dokumenty, další informace
Dědičné metabolické
poruchy aminokyselin
Chemická a fyzikální
charakteristika, struktura a povaha analytu
Histidin (His), NH2CH(CH2Im)COOH,
C6H9O2N3
m.h. 155,2
Kyselá disociační konstanta pK (25 oC)
1,82; 6,0 (Im+); 9,17
Izoelektrický bod pI 7,59
Histidin je esenciální aminokyselina v době
vývoje v dětském věku, v dospělosti je postradatelná. Podle
chemického charakteru jejího postranního řetězce ji řadíme mezi bazické
aminokyseliny a mezi aminokyseliny s elektrickým nábojem na postranním
řetězci, který se podílí na elektrostatických interakcích. Postranní řetězec má
pK blízké fyziologickému pH, může proto spontánně přijímat protony i je poskytovat
jiným látkám, a tak fungovat jako součást nábojové štafety. Imidazolový kruh je
současně dobrým nukleofilem, a tak často tvoří katalytickou skupinu aktivních
center enzymů.
Histidin obsahuje asymetrický atom uhlíku,
existuje proto ve dvou enantiomerních konfiguracích – D a L, v bílkovinách
se vyskytují pouze L-formy.
Role v metabolismu
Dva volné elektronové páry na atomech dusíku
dodávají postrannímu řetězci histidinu chelační schopnosti, takže tvoří snadno
komplexy s těžkými kovy. Dekarboxylací histidinu vzniká histamin, histamin
je biogenní amin, který má širokou škálu působení v organismu. Účastní se
alergických reakcích, způsobuje kontrakci hladkého svalstva, stimuluje
vylučování katecholaminů a sekreci kyseliny chlorovodíkové buňkami žaludeční
sliznice.
Zdroj (syntéza,
příjem)
Biosyntéza histidinu u savců není známa, u
mikroorganismů probíhá poměrně složitě. Biosyntéza začíná kondenzací ATP a
fosforibosyldifosfátu za vzniku N´-5-fosforibosyl-ATP. Z N´-5-fosforibosyl-ATP
se sledem reakcí vytvoří 5-aminoimidazol-4-karboxamidribonukleotid (meziprodukt
biosyntézy purinů) a imidazolglycerolfosfát. Z imidazolglycerolfosfátu
vzniká histidin.
Průmyslově je histidin (stejně jako většina
aminokyselin) vyráběn biosyntézou užitím mikroorganismů nebo chemickou syntézou
nebo kombinací chemické syntézy a různých biotechnologických postupů. Je používán
jako součástí krmiv pro užitková zvířata, ochucovadlo potravin, konzervační a
antioxidační přípravky.
Distribuce v
organismu, obsah ve tkáních
Histidin je přítomen ve všech tkáních a tělních tekutinách, je to hlavní
bazická aminokyselina v moči. Zvýšené hladiny lze nalézt hlavně během gravidity. K mírnému zvýšení
hladin histidinu v krvi dochází u histidinémie - benigní dědičné
metabolické poruchy z deficitu histidázy, dále u deficitu urokázy.
Poruchy
metabolismu histidinu.
Způsob vylučování nebo
metabolismusOSN-E
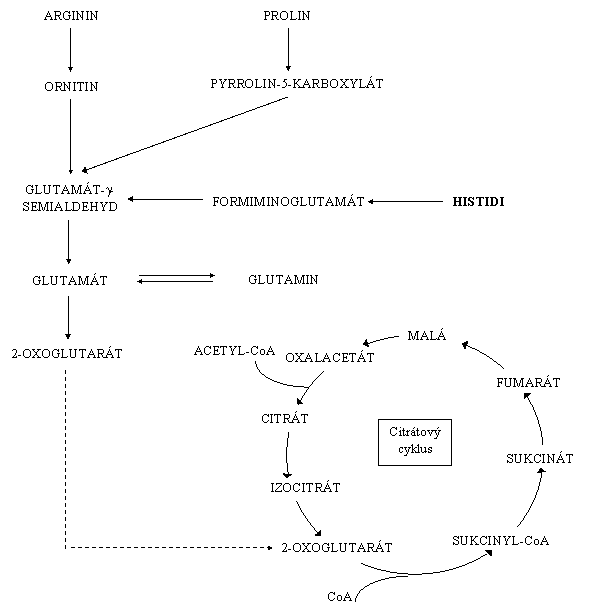
Histidin patří mezi glukoplastické aminokyseliny.
Histidin je přes několik meziproduktů (formiminoglutamát, glutamát-g-semialdehyd) odbourán na glutamát. Glutamát je oxidační
deaminací přeměně na 2-oxoglutarát. 2-oxoglutarát vstupuje do citrátového cyklu
jako konečný produkt odbourávání histidinu.
Literatura
Z.Vodrážka: Biochemie. Academia, Praha 1992.
P.Karlson, W.Gerok, W.Gross: Pathobiochemie.
Academia, Praha 1987.
Autorské poznámky
Karolína Pešková
recenzoval Viktor Kožich