Abstrakt
Chloridy jsou hlavním aniontem extracelulární tekutiny, jejich koncentrace ve venózní plazmě (séru) je nižší než v arteriální. Stanovení koncentrace chloridů v plazmě je základem pro interpretaci metabolické komponenty acidobazické situace. Vliv hydratace organismu na chloremii lze odstranit pomocí výpočtu korigovaných chloridů. K hlavním příčinám hypochloremie patří ztráty chloridů, hormonální poruchy a poruchy hydratace. Celkové příznaky zahrnují slabost a letargii, metabolickým důsledkem je hypochloremická alkalóza. Hyperchloremie může vznikat z nadbytečného přívodu chloridů, zvýšených ztrát silných kationtů, sníženého renálního vylučování, poruch hydratace a hormonálních poruch. Z příznaků dominují známky podrážděnosti, současně je ve většině případů hypernatrémie. Nejrozšířenější je potenciometrické stanovení pomocí ISE.
Odkazy na jiné relevantní dokumenty, další informace
Fyziologická variabilita
Patofyziologické mechanismy ovlivňující koncentraci
Tabulka 1
Příčiny hypochlorémie
|
Příčiny |
|
Poznámka |
|
Nedostatečný přívod chloridů |
Zcela neslaná dieta |
|
|
Ztráta chloridů extrarenálně |
Zvracení |
Při UCl- pod 10 mmol/l extrarenální původ hypochlorémie. Zvracení může být příčinou SIADH. |
|
Pylorostenóza |
Je častou příčinou SIADH. |
|
|
Laváž žaludku |
|
|
|
Ztráta žaludeční tekutiny do bursa omentalis |
Při ruptuře žaludku, probíhá skrytě jako metabolická alkalóza. Typicky téměř nulové koncentrace chloridů v moči |
|
|
Excesivní pocení při horečce nebo fyzické zátěži v horku. |
Potná žláza při adaptaci na teplo vylučuje pot o nižší koncentraci chloridů. |
|
|
Renální ztráty |
Neléčená diabetická ketoacidóza, respirační acidóza |
Kompenzace poruchy |
|
Geneticky podmíněné poruchy |
Bartterovy syndromy (OMIM 601678, 241200, 607364, 602522), Kongenitální diarrhoe typu 1 ze sekrece chloridů (OMIM 214700) |
|
|
Diuretika |
Furosemid |
|
|
Hormonální poruchy |
Addisonova choroba |
Zvýšené renální ztráty |
|
SIADH |
|
|
|
Poruchy hydratace |
Hyperosmolální dehydratace |
Pouze v situacích, kdy se výrazně změnil poměr Na+ a Cl- v neprospěch chloridů. |
|
Hypoosmolální hyperhydratace |
Obvykle je příčinou diluční hyponatrémie (s poklesem chloridů). |
|
|
Pseudohypochlorémie |
Při hyperlipidémii nebo hyperproteinémii podobným mechanismem jako vzniká pseudohyponatrémie |
Závisí na použité metodice měření chloridových aniontů. |
|
Ostatní |
Deplece draselného kationtu |
|
|
Rychlé odstranění ascitu |
|
Tabulka 2
Příčiny hyperchlorémie
|
Příčiny |
|
Poznámka |
|
Nadměrný přívod chloridů |
Infuze roztoků s SID nižším než SID plazmy |
Infuze fyziologického roztoku, KCl, CaCl2 a podobně acidifikují. |
|
Ureterosigmoideostomie |
|
|
|
Zvýšené ztráty silných kationtů |
Průjem |
Ztráta tekutiny s vysokým SID |
|
Pankreatická píštěl |
Ztráta tekutiny s vysokým SID |
|
|
Snížené renální vylučování chloridů |
Renální tubulární acidóza |
|
|
Chronické renální selhání |
|
|
|
Hypoaldosteronismus s acidózou |
|
|
|
Respirační alkalóza (chronická) |
V rámci renální kompenzace |
|
|
Léky |
Acetazolamid |
|
|
Thiazidy |
Relativně vyšší ztráta sodného kationtu |
|
|
Poruchy hydratace |
Hypertonická dehydratace |
|
|
Hypertonická hyperhydratace |
|
|
|
Hormonální poruchy |
Primární hyperparatyreoidismus |
Chloridy zastupují chybějící fosfátový anion (dříve používaný chloridofosfátový koeficient po zavedení stanovení PTH ztratil svůj diagnostický význam) |
|
Hyperkortikalismus |
|
|
|
Hyperaldosteronismus |
|
|
|
Ostatní |
Geneticky podmíněné poruchy |
Centrální diabetes insipidus (OMIM 125700), Nefrogenní diabetes insipidus X-vázaný (OMIM 304800), Nefrogenní diabetes insipidus, autosomální (OMIM 125800), Gordonův syndrom při mutacích WNK kináz (OMIM145260) |
|
Aplikace amoniumchloridu |
V rámci perorálního zátěžového acidifikačního testu |
Přímé následky abnormálních koncentrací
1) Hypochlorémie
Jako hypochlorémie je označena koncentrace chloridů v plazmě pod dolní referenční mez 98 mmol/l. Pro účely interpretace acidobazické rovnováhy se používá dolní mez korigovaných chloridů (102 mmol/l) jako hranice pro přítomnost hypochloremické alkalózy. Příčiny hypochlorémie uvádí Tabulka 1. Celkové příznaky hypochlorémie zahrnují slabost, letargii (zejména při současné hypokalémii s alkalózou), metabolickým důsledkem je hypochloremická alkalóza.
Terapie
Identifikovat zdroj hypochlorémie a léčit podle příčiny. Fyziologický roztok přináší v každém litru přibližně 50 mmol chloridů navíc (a proto acidifikuje, podobně jako koncentráty NaCl). Při současné hypokalémii podávat roztok KCl.
2) Hyperchlorémie
Jako hyperchlorémie je označena koncentrace chloridů v plazmě nad horní referenční mez 106 mmol/l. Pro účely interpretace acidobazické rovnováhy se používá horní mez korigovaných chloridů (105 mmol/l) jako hranice pro přítomnost hyperchloremické acidózy. Příčiny hyperchlorémie uvádí Tabulka 2, z příznaků dominují známky podrážděnosti, současně je ve většině případů hypernatrémie.
Referenční intervaly
|
věk |
koncentrace (mmol/l) |
|
0 dní - 4 týdny |
98 - 113 |
|
4 týdny - 99 roků |
98 - 107 |
Interference in-vivo
Omezení stanovení
Preanalytické podmínky: Pro stanovení v nekorpuskulární fázi plné krve je nutné použít titrovaný (balancovaný, iontově vyvážený) heparin. Pro stanovení v plazmě je možné použít heparin lithný nebo amonný. Pro odběr lze použít skleněné nebo plastové zkumavky, popřípadě skleněné kapiláry. Likvor se obvykle odebírá do plastové zkumavky bez úpravy. Pot se odebírá ze zad, podpaží nebo předloktí. Pot se získává pilokarpinovou iontoforézou do filtračního papíru (z kterého se eluuje destilovanou vodou) nebo plynotěsné odběrové komůrky. Pot nelze odebírat při dermatitidě.
Stabilita plné krve je při teplotě +4 až +25 °C 7 dnů. Po odstředění jsou chloridy v séru stabilní při +20 až + 25 °C 8 h, při +4 až + 8 °C 2 týdny a při ‑20 °C 1 rok. Stabilita chloridů při stanovení v moči 2 h při +20 až + 25 °C a 24 h při +4 až +8 °C; při pozdější analýze je třeba moč okyselit kyselinou boritou na pH < 3 a uložit do lednice. Postprandiální koncentrace chloridů v séru jsou nepatrně nižší než při odběrech na lačno. Hemolýza stanovení chloridů neruší, ale při velmi silné hemolýze naměříme snížené hodnoty v důsledku dilučního efektu. Hodnoty koncentrace chloridů v potu kolísají podle menstruačního cyklu.
Použití ve výpočtech a odvozených parametrech
Frakční exkrece Cl se vypočte podle vzorce
FECl =UCl/SCl/UKrea*SKrea/1000
kde UCl je koncentrace Cl- v moči v mmol/l, SCl je koncentrace Cl- v séru (plazmě) v mmol/l, UKrea je koncentrace kreatininu v moči v mmol/l a SKrea je sérová koncentrace kreatininu v séru (plazmě) v µmol/l. Protože se profiltruje 18000 mmol chloridového aniontu za den (180 litrů glomerulárního filtrátu při průměrné koncentraci 100 mmol/l) a eliminuje se močí kolem 150 mmol/den, je teoretická frakční exkrece 0,008 (tj. 0,8 %). Analýzou vlastních dat jsme zjistili medián FECl 0,0076 (tj. 0,76 %) s navrhovaným referenčním rozmezím 0,003 – 0,020 (tj. 0,3 – 2,0 %).
Další výpočty
Koncentrace chloridů je nutná pro výpočet anion gap a korigovaného anion gap a pro výpočet tzv. neměřených aniontů. Tyto ukazatele se používají pro interpretaci acidobazického nálezu. Koncentrace chloridů se dále dříve používala v tzv. chloridofosfátovém koeficientu v séru (plazmě), jehož zvýšení indikovalo možnost primární hyperparatyreózy. V dnešní době již tento výpočet nemá význam.
Vztah chloridového aniontu a acidobazického stavu
Korigované chloridy
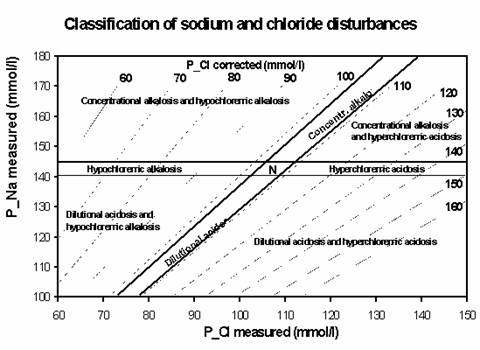
Korigované chloridy se vypočítávají za účelem zjištění podílu hydratace na změně koncentrace chloridů. Ukazují, jaká by byla koncentrace chloridových aniontů při fyziologické koncentraci Na+ (obvykle se koriguje na 140 mmol/l Na+). Při grafickém uspořádání (Obrázek 1) lze korigované chloridy využít pro zařazení acidobazické situace do jedné z možných oblastí acidobazických poruch. Pokud je pacient v pásmu hypochloremické alkalózy, je vhodné analyzovat koncentraci chloridů v moči. Pokud je nižší než 10 mmol/l, je hypochlorémie podmíněna extrarenálními ztrátami chloridů. Pokud je vyšší než 10 mmol/l, je hypochloremická alkalóza podmíněna renálně z různých příčin (Bartterovy syndromy a podobně).
Obrázek 1
Aktuální nález pacienta představuje bod určený koncentrací Na+ (osa y) a Cl- (osa x). Na šikmých osách se odečte hodnota korigovaných chloridů. Současně je nález pacienta zařazen s ohledem na možnou přítomnost koncentrační alkalózy, diluční acidózy, hypochloremické alkalózy a hyperchloremické acidózy. N = fyziologický nález.
Znaky analytické metody
Stanovení chloridového aniontu
Biologická variabilita intraindividuální / interindividuální (%): 1,20 / 1,50
Požadovaná nepřesnost / bias (%): 0,60 / 0,50
Požadovaná celková chyba (%): 1,50
Kritická diference (požadovaná nepřesnost, intraindividuální variabilita, v %): 3,7
Metodiky stanovení:
Potenciometrie: měří se aktivita chloridového aniontu ve zředěném vzorku nebo v neředěném vzorku. Většina současných analyzátorů používá ředění vzorku před potenciometrickou analýzou. Nejvíce používaná je iontově-výměnná membrána obsahující kvarterní amoniovou sůl jako anex, např. tri-n-oktylpropylamoniumchlorid v n-dekanolu. Kapalná membrána může obsahovat také o-fenantrolin. Méně časté jsou chloridové elektrody obsahující tabletu AgCl zapuštěnou v lůžku z epoxidové pryskyřice či silikonového kaučuku. Existuje také aplikace potenciometrie na pevné fázi. V tomto případě se provádí měření bez ředění a vzorek se dávkuje paralelně s referenčním roztokem speciální dvoukanálovou multipipetou. Lineární odezva chloridové elektrody je v intervalu 1 – 100 mmol/l. Přestože se často upozorňuje na nestabilitu chloridových elektrod (skutečně jejich životnost je ve srovnání se sodnými a draselnými elektrodami podstatně nižší) a nekonzistenci v selektivitě mezi jednotlivými šaržemi elektrod, je tento způsob stanovení chloridových iontů v biochemických laboratořích nejrozšířenější.
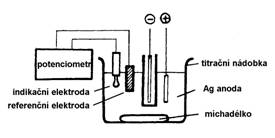
Coulometrická titrace (Obrázek 2): principem je srážecí argentometrická titrace s potenciometrickou detekcí. Ze stříbrné anody se elektrickým proudem uvolňuje kation stříbrný, který reaguje s chloridovým aniontem z roztoku za vzniku nerozpustného chloridu stříbrného. Pomocí stříbrných registračních elektrod se měří potenciál roztoku a registruje se okamžik, kdy všechny chloridové anionty byly spotřebovány ve srážecí reakci. Odpovídající potenciál je zajištěn referenční merkurosulfátovou (Hg2SO4) elektrodou. Titrace se provádí ve zředěné kyselině sírové. Při titraci se sleduje jak dlouhý čas je zapotřebí při konstantním proudu k vytitrování chloridů. Sledujeme tedy prošlý náboj (C = I . t), jehož jednotkou je coulomb a odtud i název metody coulometrie. Coulometrické titrátory (chloridometry) bývají adjustovány tak, aby prošlý náboj za 1 s odpovídal koncentraci chloridů 1 mmol/l. Metoda je velmi spolehlivá a slouží jako referenční metoda ke stanovení chloridů. Většina automatických analyzátorů používá kombinaci sodné, draselné a chloridové ISE. Nicméně i coulometrický postup je automatizovatelný a můžeme jej vidět u některých statimových analyzátorů s paralelními analytickými kanály. Coulometrie je doporučována pro analýzy chloridů v potu.
Obrázek 2
Schéma coulometru
Merkurimetrie: běžně používaným principem je reakce s rodanidem rtuťnatým Hg(SCN)2, kdy s chloridovým aniontem vzniká HgCl2 a rodanidový anion, který se prokazuje barevnou reakcí s železitým kationtem:
Hg(SCN)2 + 2 Cl– è HgCl2 + 2 SCN–
3 SCN– + Fe3+ è Fe(SCN)3
Využívá se merkurimetrického principu, kdy vzniká nedisociovaný a ve vodě rozpustný chlorid rtuťnatý a uvolněné rodanidové ionty poskytují intenzivně červeně zbarvený rodanid železitý, jehož zbarvení se sleduje při 480 nm. Metoda má úzkou oblast linearity a proto je zcela nevhodná pro sledování chloridů v moči, navíc při reakci vzniká vysoce toxický sublimát.
Původní merkurimetrická titrace používala roztok disociovaného dusičnanu rtuťnatého z kterého vznikal nedisociovaný chlorid rtuťnatý. K titrovanému roztoku se přidal indikátor, např. difenylkarbazon, který z volnými rtuťnatými ionty (po vyvázání veškerých chloridů) poskytoval modrofialový komplex. Tento postup je lineární v celém rozsahu a v případě zručného pracovníka i velmi spolehlivý; po vytřepání do tetrachlormetanu (dalšího jedu) i velmi citlivý. Nicméně jedná se o manuální analytický postup s jedovatými látkami.
Spektrofotometrie: chloranilan rtuťnatý je v kyselém prostředí štěpen chloridy na kyselinu chloranilovou a vznikající fialové zbarvení se měří po 10 min při 510 -550 nm.
Jiný postup, který nepoužívá jedovaté rtuťnaté soli, je reakce chloridových iontů s chloristanem železitým v prostředí zředěné kyseliny chloristé a měření absorpčního maxima 344 nebo 562 nm.
Kinetická metoda stanovení chloridů je založená na tom, že savčí α-amyláza je deaktivována tak, že chelát etylendiamintetraoctové kyseliny (EDTA) komplexuje její vápenatý ion. Chloridy pak způsobí její reaktivaci tím, že uvolní Ca2+ z EDTA a umožní, aby se znovu navázal na α-amylázu. V postupu se následně jako substrát používá 2-chlor-4-nitrofenyl-β-D-maltoheptaosid a doprovodné enzymy α-glukozidáza a β-glukozidáza. Kinetiku vznikajícího 2-chlor-4-nitrofenolu lze sledovat při 405 nm i na automatickém analyzátoru. Metoda je lineární v rozsahu 40 až 160 mmol/l a není tedy vhodná pro stanovení chloridů v moči. Reprodukovatelnost je vynikající (CV < 1 %), ale přesto se metoda nerozšířila i když je známá od roku 1988. Důvodem je patrně to, že stanovení amylázy patří k nejdražším běžným analýzám v klinické biochemii a postup s iontově selektivní elektrodou bude několikanásobně levnější.
Fluorimetrie využívá se změny fluorescence barviva (Chromoionophore VI nebo deriváty porfyrinů) na povrchu optického vlákna (optoda) podle koncentrace chloridů. Chloridový anion je vychytávaný ionoforem, který má funkci Lewisovy kyseliny ([9]mercuracarborand-3) a je selektivní vůči chloridům. Postup je použitelný u analyzátorů POCT v záchranné službě.
Argentometrie: pro úplnost se zmiňujeme ještě o argentometrické titraci chloridů dusičnanem stříbrným. Vzniká nerozpustný chlorid stříbrný až do vyčerpání chloridů a první přebytek volných stříbrných iontů se detekuje potenciometricky nebo konduktometricky.
Interpretační poznámky se vztahem k analytice:
Prakticky ve všech metodách (coulometrie, spektrofotometrie) interferují bromidové anionty, které se mohou v biologických vzorcích prakticky jako jediné z halogenů (F–, Cl–, Br–, I–) vyskytnout. Bromidy se vyskytují v některých hypnoticích a při dlouhodobém používání mohou vést ke koncentraci v plazmě i více než 5 mmol/l. Interference jodidů při stanovení ISE se v novější literatuře již neuvádí. Rovněž rodanidy, které mohou rozpouštět polymerní iontově-výměnnou membránu, by se neměly v biologickém materiálu vyskytovat.
Ekonomické náklady
Použití pro klinické účely
Praktické poznámky
- Stanovení chloridů v séru (plazmě) je základem pro interpretaci metabolické komponenty acidobazické situace. Je nutné zajistit současný odběr krve na acidobazickou analýzu a stanovení chloridů (a ostatních relevantních ukazatelů, především natrémie).
- Koncentraci chloridů v plazmě je možné „očistit“ od vlivu hydratace pomocí výpočtu korigovaných chloridů
- U hypochloremické alkalózy je nutné posoudit důvod poruchy vyšetření chloridů v moči – koncentrace pod 10 mmol/l svědčí pro extrarenální ztráty chloridů. Při bulimii (s utajeným zvracením) je ze stejných důvodů nízká koncentrace chloridů důkazem špatné compliance pacienta.
LiteraturaOSN-E
Poznámky
Koncentrace chloridů ve venózní plazmě je nižší než v arteriální, protože koncentrace chloridů v erytrocytech žilní krve je vyšší než v erytrocytech krev arteriální. Je to způsobeno chloridovým posunem (chloride shift, Hamburgerův shift), který je podmíněn zvýšenou afinitou chloridového aniontu k deoxyhemoglobinu, vstupem Cl- do erytrocytů ve venózní krvi a výstupem HCO3- z erytrocytů ve venózní krvi. Tvorbu hydrogenkarbonátu zajišťuje karbonátdehydratáza erytrocytů (karboanhydráza). Při snížení pCO2 v plicích se chloridy vrací zpět do erytrocytů.
AppendixyOSN-E
Autorské poznámky
Antonín Jabor (2007)