Abstrakt
IgE je jedna ze tříd imunoglobulinů o Mr 190 kDa. Jeho fyziologická funkce je v oblasti protiparazitární imunity. Zvýšené hodnoty se objevují u alergií, parazitóz, autoimunních chorob, malignit a hyperimunoglobulinémie E syndromu.
Terminologie
Synonyma
Klasifikační kódy
Odkazy na jiné relevantní dokumenty, další informace
Chemická a fyzikální charakteristika, struktura a povaha analytuOSN-E
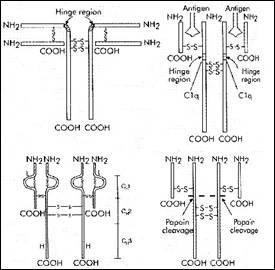
Obrázek z L.Thomas, Clinical Laboratory Diagnostics, str. 668 znázorňuje strukturu globulinu v T formě (nahoře vlevo), ve V formě (nahoře vpravo), lokalizaci V oblasti a domény CH1,2,3 těžkých řetězců (vlevo dole), lokalizaci štěpného místa papainem a následný vznik Fc a Fab fragmentů s antigen vazebnými místy, C1q= vazebné místo pro komplement
Imunoglobuliny v základní struktuře mají dva identické těžké řetězce (H) s molekulovou hmotností 50 kDa a dva lehké řetězce (L) okolo 22 kDa. Řetězce jsou k sobě poutány různým počtem disulfidických vazeb. H a L řezce jsou tvořeny částí variabilní (V) a konstantní (C). Těžké i lehké řetězce mají vedle sebe společně N-terminální konce, skládají se ze série globulárních oblastí z významných homologních aminokyselinových sekvencí (AMK) označovaných jako domény. N-terminální domény
H a L řetězců obsahují variabilní aminokyselinové sekvence (V oblast), které determinují antigenní specifitu. N-terminální AMK ve V oblasti formují funkční region, kam se usadí antigenní epitop. Povrchy vazebných míst a epitopů jsou navzájem komplementární a podle struktury, výběžků, se právě jedině ten správný epitop ze všech naváže na patřičné vazebné místo. Komplementarita není pouze strukturální, ale i chemická a to na podkladě van der Waalsových sil. Jedná se o vodíkové vazby mezi polárními skupinami, o vytvoření iontových vazeb mezi různě nabitými stranami řetězců. Mezi V oblastí a zbývající částí konstantního H řetězce (CH) jsou strukturní a antigenní rozdíly, které imunoglobuliny rozdělují do podtříd. Například u IgG molekul CH domény mají následující funkce: první (CH1) a druhá (CH2) doména formují „skryté místo“, které odpovídá za transformaci z T formy (v roztoku) do V formy při navázání antigenu. CH1 doména se váže na složky komplementu C1q, které vedou k aktivaci klasické cesty kaskády komplementárního systému. Třetí doména (CH3) zprostředkovává vazbu Fc fragmentu na Fc receptor buněk imunitního systému -granulocyty, monocyty, makrofágy. Kombinace CH2 a CH3 společně tvoří další doménu pro vazbu např. granulocytů a NK (natural killers) buněk.
Papain štěpí molekulu imunoglubulinu na tři části, dva identické Fab fragmenty sestávající z kompletních L řetězců (V oblast) a části konstantních H řetězců. Zbývající segment z konstantních oblastí dvou těžkých řetězců spojených disulfidickými můstky je označován jako Fc fragment (c=crystallizable, krystalizující).
Lehké řetězce jsou typu kappa nebo lambda. Každá molekula má dva kappa nebo 2 lambda L řetězce, protože každá B buňka je schopna produkovat pouze jeden typ lehkých řetězců. Lehké řetězce mají N (amino)-terminální, variabilní a C (karboxy) terminální, konstantní konce. L řetězce jsou připojeny k H řetězců prostřednictvím disulfidických můstků, které vytváří cystinové molekuly mezi konstantními oblastmi obou typů řetězců. B lymfocyty produkují průměrně dvakrát více kappa řetězců než lambda. Termín monoklonální lehké řetězce nebo Bence Jones bílkovina je v podstatě důsledek sekrece maligně transformovaných a proliferujících buněk kmene B lymfocytů produkující daný typ L řetězců.
Uvolňování L řetězců z vazby je umožněno sklony cystinových molekul k snadné dimerizaci.
Struktura H řetězce je daná třídou daného imunoglobulinu. Rozdíly mezi imunoglobulinovými skupinami jsou v jejich aminokyselinovém složení, sekvenci, molekulové hmotnosti, v sacharidových zbytcích, antigenitě, alotypové heterogenitě a elektroforetické mobilitě. Je 5 základní skupin těžkých řetězců, každá má dva identické řetězce, IgG skupina má dva γ (gama) těžké řetězce, IgA má α (alfa) řetězce, IgM má µ (mí) řetězce, IgD-δ (delta) řetězce, IgE ε (epsilon) dva těžké řetězce.
J řetězce jsou spojky mezi samotnými molekulami globulinů. Imunoglobuliny třídy IgM a IgA vykazují polymorfismy. IgM molekuly se vyskytující zejména jako pentametry, IgA jako dimer. IgM monomery stejně tak jako IgA monomery jsou spojeny právě prostřednictvím J řetězců. J řetězce jsou glykoproteiny o molekulové hmotnosti 15 kDa a cestou disulfidických vazeb poblíž C terminálních konců spojují mezi sebou těžké řetězce imunoglobulinů.
Sekreční dimery IgA, které jsou produkovány plazmocyty respiračního, urogenitálního a gastrointestinálního traktu a uvolňovány do tělních tekutin s obsahem sekreční komponenty, která chrání imunoglobuliny před štěpícími účinky peptidáz. Sekreční komponenta je glykoprotein s molekulovou hmotností 70 kDa. Dimerické molekuly IgA se nenavážou na sekreční komponenty dokud neprojdou epiteliálním povrchem sliznic, které sekreční komponentu syntetizují. V případě sekreční IgA deficience, je sekreční komponenta stanovitelná.
Antigenní heterogenita se dělí na izotypovou, alotypovou, idiotypovou. Izotypy mají stejné konstantní domény. Izotypové variace mají odlišnosti v H, L řetězcích, doménách, které jsou prezentovány ve všech zdravých jedincích daného druhu. Syntéza izotopů je kódována geny příslušného jedince a druhu. Alotypová variace je definována jako alelou indukovaná variace imunoglobulinu uvnitř druhu. Alotypy se objevují jako variace konstantní části H řetězce. Alotypové variace jsou často důsledek AMK výměn uvnitř H řetězce. Idiotypy mají stejné variabilní domény. Idiotypové variace souvisí s rozmanitostí v antigenních vazebných místech. Imunoglobuliny syntetizované jedním klonem plazmatických buněk jsou normálně kompletně identické, vytváří uniformní idiotyp. Alterace, změny AMK ve V oblasti vytváří idiotypové variace. Stejně tak antigeny můžeme dělit na stejné izotypy nebo alotypy. V případě paraproteinů se jedná pravděpodobně o idiotypovou variaci.
Role v metabolismu
Epsilon řetězce jako mí řetězce mají 5 domén. Jejich distribuce je v organismu stejná jako IgA. Sérová koncentrace IgE nevyjadřuje efektivní koncentraci IgE v organismu. Místa největší syntézy jsou respirační trakt, gastrointestinální a lymfatické uzliny. IgE je vázáno na IgE receptory mastocytů. IgE se váže na 2 různé typy buněčných receptorů, klasický vysoce afinitní receptor (Fc ε RI) na mastocytech a bazofilech a nízce afinitní receptor CD 23 (Fc ε RII) na povrchu eozinofilů, lymfocytů a monocytů. IgE protilátky zprostředkovávají hypersenzitivní reakci I. typu. Neškodné polyvalentní alergeny jako pyly, domácí prach, stimulují B buňky k produkci specifických IgE. Tento proces je zprostředkován CD4+ Th2 buňkami. Během dalšího kontaktu s polyvalentním antigenem senzibilizované mastocyty pomocí IgE jsou degranulovány, což vede k uvolnění mediátorů s projevy senné rýmy, astmatu, atopického ekzému.
Zdroj (syntéza, příjem)
V séru zdravých jedinců se nachází všechny třídy imunoglobulinů: IgG, IgA, IgM, IgD, IgE ve fyziologické koncentraci. IgG má 4 podtřídy, u IgA a IgM jsou známy dvě podtřídy.
Distribuce v organismu, obsah ve tkáních
Způsob vylučování nebo metabolismus
Biologický poločas
2,5 dne
Kontrolní (řídící) mechanismy
Literatura
Lothar Thomas, Clinical Laboratory Diagnostics, 1st. English Edition, TH-Books, Germany 1998
Poznámky
Appendixy
Autorské poznámky
Jiřina Lukášková (2008)