Abstrakt
Methionin patŇô√≠ mezi z√°kladn√≠ esenci√°ln√≠ glukoplastick√© aminokyseliny. Je
hlavn√≠m zdrojem metylov√Ĺch skupin pŇôedevŇ°√≠m pro synt√©zu cholinŇĮ, kreatininu a
adrenalinu v organismu. Adenozylmethionin (metabolicky aktivní forma
methioninu) je tak√© v√Ĺznamn√Ĺm donorem metylov√Ĺch skupin a pŇĮsob√≠ jako koenzym
metyltransfer√°z. D√°le je
inhibitorem methylentetrahydrofol√°t redukt√°zy (MTHFR) a aktiv√°torem
cystathionin-beta-synt√°zy (CBS).
Terminologie
Methionin, 2-amino-4-(metylthio)butyr√°t
Synonyma
2-amino-4-(metylthio)butyr√°t
Odkazy na jiné
relevantn√≠ dokumenty, dalŇ°√≠ informace
Dńõdińćn√©
metabolické poruchy aminokyselin
Adenosylhomocystein
Chemická a fyzikální
charakteristika, struktura a povaha analytu
Methionin (Met), NH2CH(CH2CH2SCH3)COOH,
C5H11O2SN
m.h. 149,2
Kysel√° disociańćn√≠ konstanta pK (25 oC)
2,28; 9,21
Izoelektrick√Ĺ bod pI 5,74
Methionin je esenciální aminokyselina, tzn. nelze
ji v organizmu syntetizovat, mus√≠ se z√≠skat potravou nebo Ň°tńõpen√≠m
tk√°Ňąov√Ĺch b√≠lkovin. Jej√≠ postrann√≠ Ňôetńõzec m√° do znańćn√© m√≠ry hydrofobn√≠
charakter (uplatŇąuje se v hydrofobn√≠ch interakc√≠ch b√≠lkovin), methionin
Ňôad√≠me tedy mezi nepol√°rn√≠ aminokyseliny. Obsahuje lehce polarizovateln√Ĺ atom
s√≠ry, na kter√Ĺ se v√°Ňĺe adenozyl (z ATP) za vzniku adenozylmethioninu.
Methionin obsahuje asymetrick√Ĺ atom uhl√≠ku,
existuje proto ve dvou enantiomern√≠ch konfigurac√≠ch ‚Äď D a L, v b√≠lkovin√°ch
se vyskytují pouze L-formy.
Role v metabolismu
Methionin je
hlavn√≠m zdrojem metylov√Ĺch skupin v organismu, pŇôedevŇ°√≠m pro synt√©zu cholinŇĮ,
kreatinu, methylnikotinamidu a adrenalinu. S-adenozylmethionin (metabolicky
aktivn√≠ forma methioninu) nav√≠c pŇĮsob√≠ jako koenzym metyltransfer√°z, kter√©
katalyzuj√≠ pŇôenos metylov√© skupiny na rŇĮzn√© akceptory.
Zdroj (syntéza,
pŇô√≠jem)
Methionin patŇô√≠ mezi esenci√°ln√≠ aminokyseliny,
nelze ji tedy v organizmu syntetizovat, jej√≠ biosynt√©za prob√≠h√° vesmńõs jen
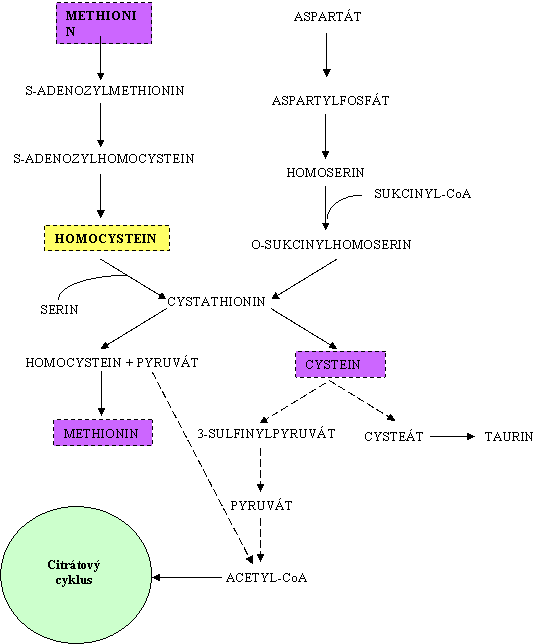
u rostlin a mikroorganismŇĮ. Prekurzorem synt√©zy methioninu je aspart√°t,
z aspart√°tu vznik√° homoserin, kter√Ĺ reaguje se sukcinylkoenzymem A a
cysteinem za vzniku cystathionu. Ten je hydrolyticky Ň°tńõpen na homocystein a
pyruv√°t. Homocystein je metylov√°n na methionin.
PrŇĮmyslovńõ je methionin vyr√°bńõn chemickou
synt√©zou, kdy je v√Ĺchoz√≠ surovinou propylen. Je pouŇĺ√≠v√°n pŇôedevŇ°√≠m jako pŇô√≠sada
do krmiv pro uŇĺitkov√° zv√≠Ňôata.
 
Distribuce v
organismu, obsah ve tkáních
Methionin (OMIM 250850) je ubikvitern√≠ aminokyselina vŇ°ech tk√°n√≠ a
tekutin.
Patologicky zv√ĹŇ°en√©
hladiny v krvi jsou zaznamen√°ny u Ňôady dńõdińćn√Ĺch poruch metabolismu sirn√Ĺch
aminokyselin, jako
napŇô. u homocystinurie z deficitu cystationin beta-synt√°zy. Velmi v√Ĺrazn√©
zv√ĹŇ°en√© hladiny methioninu lze nal√©zt u deficitu methioninadenozyltransfer√°zy. U remetylańćn√≠ch poruch b√Ĺvaj√≠ hladiny
methioninu sn√≠Ňĺen√© ńći norm√°ln√≠ a
hladiny cystathioninu v√Ĺraznńõ zv√ĹŇ°en√©.
Sekund√°rnńõ mŇĮŇĺe doj√≠t ke zv√ĹŇ°en√≠ hladiny homocysteinu v mońći pŇôi deficitu
vitam√≠nu B12. Zv√ĹŇ°en√°
koncentrace fol√°tŇĮ zase inhibuje transmetylańćn√≠ reakci, kter√° vede ke zv√ĹŇ°en√©
hladinńõ S-adenosyl-methioninu .
Poruchy metabolismu sirn√Ĺch AMK.
ZpŇĮsob vyluńćov√°n√≠ nebo
metabolismusOSN-E
Methionin patŇô√≠
mezi glukoplastick√© aminokyseliny. Odbour√°v√°n√≠ methioninu prob√≠h√° takto: methionin je pŇôemńõnńõn na homocystein (50%
dostupn√©ho homocysteinu je recyklov√°no zpńõt na methionin). Homocystein mŇĮŇĺe b√Ĺt
tak√© slouńćen se serinem a vytvoŇôit cystathionin (za pŇô√≠tomnosti
pyridoxalfosf√°tu). Cystathionin je deaminov√°n a Ň°tńõpen na cystein a
2-oxobutyr√°t. Cystein je odbour√°n pŇô√≠mo na pyruv√°t, ten je oxidańćn√≠
dekarboxylac√≠ pŇôemńõnńõn na acetylkoenzym A (acetylCoA). AcetylCoA vstupuje do
citr√°tov√©ho cyklu jako koneńćn√Ĺ produkt odbour√°v√°n√≠ methioninu.
Literatura
Z.Vodr√°Ňĺka: Biochemie. Academia, Praha 1992.
P.Karlson, W.Gerok, W.Gross: Pathobiochemie.
Academia, Praha 1987.
Autorské poznámky
Karol√≠na PeŇ°kov√°
recenzoval Viktor KoŇĺich