Abstrakt
Luminiscence je emise
sv─Ťtla, kdy┼ż se elektron vrac├ş z excitovan├ęho stavu nebo vy┼í┼í├ş energetick├ę
hladiny na ni┼ż┼í├ş energetickou ├║rove┼ł. Podle toho, jak je elektron aktivov├ín do
excitovan├ęho stavu a jak├Żm zp┼»sobem je pak jeho energie vyz├í┼Öena, se jedn├í o
fluorescenci, fosforescenci nebo luminiscenci (chemiluminiscenci).
Souvisej├şc├ş informace
Text
Luminiscence
je emise sv─Ťtla, kdy┼ż se
elektron vrac├ş z excitovan├ęho stavu nebo vy┼í┼í├ş energetick├ę hladiny na
ni┼ż┼í├ş energetickou ├║rove┼ł
Druhy luminiscence:
fluorescence,
fosforescence,
chemiluminiscence
rozd├şl je v tom, jak je
elektron aktivov├ín do excitovan├ęho stavu a jak├Żm zp┼»sobem je vyz├í┼Öena
energie
|
|
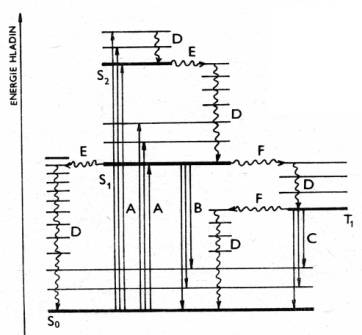
Sch├ęma energetick├Żch
hladin molekuly a p┼Öechod┼» mezi nimi: Rovn├ę ┼íipky p┼Öedstavuj├ş
z├í┼Öiv├ę p┼Öechody (d─Ťje spojen├ę s absorpc├ş nebo emis├ş fotonu), vlnovky
ozna─Źuj├ş nez├í┼Öiv├ę p┼Öechody |
Absorpce
- kvantum sv─Ťteln├ę energie pohlcen├ę molekulou
zp┼»sob├ş p┼Öem├şst─Ťn├ş elektronu ze z├íkladn├şho singletov├ęho stavu do jedn├ę
z mo┼żn├Żch excitovan├Żch posic (singletov├Żch nebo v├Ż┼íe tripletov├Żch)
- je-li molekula v excitovan├ęm stavu, je
n─Ťkolik cest n├ívratu k p┼»vodn├şmu energetick├ęmu stavu:
singlet excitovan├Ż ┬« singlet ust├ílen├Ż = fluorescence 10-8
s
triplet excitovan├Ż┬á ┬« singlet ust├ílen├Ż = fosforescence 10-4 s -
100 s (del┼í├ş)
Fluorescence
┬Ě
druh luminiscence,
u n├ş┼ż doch├íz├ş k emisi sv─Ťtla v ─Źase krat┼í├şm ne┼ż 10-8 s po buzen├ş
┬Ě
je emise
elektromagnetick├ęho z├í┼Öen├ş p┼Öi p┼Öechodu mezi dv─Ťma stavy t├ę┼że multiplicity
(obvykle dv─Ťma singlety)
┬Ě
molekuly absorbuj├ş
sv─Ťtlo p┼Öi jedn├ę vlnov├ę d├ęlce (excita─Źn├ş) a reemituj├ş p┼Öi v─Ťt┼í├ş vlnov├ę
d├ęlce (emisn├ş), klasick├ę fluorofory: fluorescein, rhodamin, methylumbelliferon
Fosforescence
┬Ě
emise z├í┼Öen├ş p┼Öi
p┼Öechodu mezi dv─Ťma stavy rozd├şln├ę multiplicity (triplet - singlet)
Chemiluminiscence
┬Ě
vznik├í vyz├í┼Öen├şm fotonu
z molekuly luminoforu po jeho chemick├ę oxidaci
┬Ě
sv─Ťtlo emitovan├ę vznik├í
oxida─Źn├ş reakc├ş organick├Żch slou─Źenin (luminol, isoluminol, luciferin)
p┼»soben├şm oxidant┼» (H2O2 , O2 , ClO4- )┬á
Bioluminiscence: zvl├í┼ítn├ş forma chemiluminiscence - nap┼Ö. enzymy
lucifer├íza, alkalick├í fosfat├íza zvy┼íuj├ş efekt luminiscen─Źn├ş reakce
Elektrochemiluminiscence
(Elecsys)
je modifikace
chemiluminiscence, kdy sv─Ťtlo je generov├íno s├ęri├ş chemick├Żch reakc├ş
iniciovan├Żch elektrochemicky
Na elektrod─Ť je dvojmocn├í
s┼»l ruthenia oxidov├ína na trojmocnou, z├írove┼ł je tripropylamin (TPA) oxidov├ín
na radik├íl TPA+, tento radik├íl m├í reduk─Źn├ş vlastnosti, proto snadno
redukuje trojmocn├Ż rutenit├Ż komplex na dvojmocn├Ż, velk├Ż rozd├şl potenci├íl┼»
zp┼»sob├ş, ┼że elektron z TPA p┼Öesko─Ź├ş do vy┼í┼í├ş energetick├ę hladiny
ruteniov├ęho kationtu, p┼Öechodem tohoto elektronu do z├íkladn├şho stavu se vyz├í┼Ö├ş
foton (luminiscence) a rutheniov├Ż komplex j op─Ťt schopen dal┼í├ş
oxidace
- rutheniov├Ż kationt proch├íz├ş reakc├ş cyklicky,
nespotřebovává se, chová se jako enzym
- TPA se rozpadá na dipropylamin, je v reakci
spot┼Öebov├ív├ín, slou┼ż├ş jako substr├ít
- antigen, protilátka
se vazbou streptavidin-biotin pevn─Ť nav├í┼żou na magnetick├ę polystyrenov├ę
mikro─Ź├ístice,
- pou┼żit├şm
mikro─Ź├ístic je dosa┼żeno velk├ę reak─Źn├ş plochy pro imobilizaci
imunologick├Żch reaktant┼»
- mikro─Ź├ístice jsou
rozpt├Żleny┬á v roztoku,
podm├şnky se tedy bl├ş┼ż├ş homogenn├ş reakci
- po skon─Źen├ş
inkubace se reak─Źn├ş sm─Ťs nasaje do pr┼»tokov├ę kyvety, kde je um├şst─Ťn
elektromagnet,
- v┼íechny magnetick├ę
mikro─Ź├ístice s nav├ízan├Żmi imunoreaktanty jaou magnetem p┼Öita┼żeny
(v┼íechny nenav├ízan├ę ─Ź├ístice projdou, nen├ş t┼Öeba proplachovat b─Ťhem
inkubace),
- po propl├íchnut├ş
kyvety se nasaje substrát - TPA,
- vlastn├ş
elektrochemiluminiscence se startuje vlo┼żen├şm nap─Ťt├ş na elektrodu
um├şst─Ťnou p┼Ö├şmo nad magnetem,
- m─Ť┼Öen├ş sign├ílu se
prov├íd├ş foton├ísobi─Źem
Autorsk├ę pozn├ímky
Jaroslava Vávrová