Abstrakt
Vyysoko├║─Źinn├í kapil├írn├ş elektrofor├ęza (HPCE) umo┼ż┼łuje
vyu┼ż├şt v┼íechny z├íkladn├ş elektromigra─Źn├ş techniky - z├│novou elektrofor├ęzu (CZE),
isoelektrickou fokusaci (CIEF), izotachoforetick├ę d─Ťlen├ş (ITP), gelovou elektrofor├ęzu
(CGE). Micel├írn├ş elektrokinetick├í chromatografie (MEKC) umo┼ż┼łuje mimo jin├ę
elektromigra─Źn├ş separaci neionogenn├şch slou─Źenin. Z├íkladn├ş instrumentace HPCE
v┼żdy obsahuje alespo┼ł jednu separa─Źn├ş kapil├íru, zdroj nap─Ťt├ş, d├ívkova─Ź vzorku,
detektor a za┼Ö├şzen├ş pro z├íznam analytick├ęho sign├ílu.
Souvisej├şc├ş informace
┬Ě
Elektrofor├ęza v polyakrylamidov├ęm gelu
Text
1.
Úvod
2.
Micel├írn├ş
elektrokinetická chromatografie (MEKC)
3.
Elektroosmotick├Ż
tok (EOF)
4.
Instrumentace
v HPCE
- Kapiláry
- Zdroj nap─Ťt├ş
- D├ívkov├ín├ş vzorku
- Detekce
5.
Aplikace
HPCE v klinick├ę chemii
A.
Předúpravy
vzorků
B.
N─Ťkter├ę
oblasti aplikac├ş HPCE, p┼Ö├şklady
B.1. Aminokyseliny
B.2. L├ęky
B.3. Vitaminy
B.4. Katecholy a
katecholaminy
B.5. Peptidy,
proteiny, glykoproteiny
B.6. Kortikosteroidy
B.7. Organick├ę
kyseliny
B.8. Mal├ę ionty
B.9. Nukleotidy,
oligonukleotidy a nukleov├ę kyseliny
1.
Úvod:
Vysoko├║─Źinn├í kapil├írn├ş elektrofor├ęza (HPCE) - spl┼łuje
z├íkladn├ş po┼żadavky na modern├ş separa─Źn├ş techniku:
- rychlost anal├Żzy,
- minim├íln├ş objem vzorku,
- vysok├í separa─Źn├ş ├║─Źinnost,
- modifikace separa─Źn├şch podm├şnek a jejich kombinace v r├ímci jedn├ę
anal├Żzy: z├│nov├í elektrofor├ęza (CZE), isoelektrick├í fokusace (CIEF),
izotachofor├ęza (ITP),z├│nov├í elektrofor├ęza na gelu (CGE), micel├írn├ş
elektrokinetická chromatografie (MEKC),
- detek─Źn├ş modifikace: UV, DAD, LIF, amperometrick├Ż, konduktometrick├Ż,
hmotnostn├ş,
- automatizovatelnost.
2.
Micel├írn├ş elektrokinetick├í chromatografie (MEKC)
MEKC umo┼ż┼łuje mimo jin├ę elektromigra─Źn├ş separaci
neionogenn├şch slou─Źenin. Pou┼żit├şm surfaktantu v elektrolytu (anionogenn├ş nap┼Ö.
sodium dodeczl sulf├ít (SDS), ┼żlu─Źov├ę kyseliny, kationogenn├ş
cetyltrimethylamonium chlorid (CTAC), neionogenn├ş Triton X-100) vznikaj├ş
koloidn├ş shluky (micely) na povrchu pol├írn├ş a uvnit┼Ö nepol├írn├ş. Umo┼ż┼łuje
separovat ionty s n├şzkou pohyblivost├ş.
3. Elektroosmotick├Ż tok (EOF)
N├íboj u st─Ťny kapil├íry ovliv┼łuje profil sn├şman├ęho
sign├ílu detekovan├ę l├ítky. Potla─Źuje se u CZE, vyu┼ż├şv├í se u MEKC.
3.
Instrumentace v HPCE
Z├íkladn├ş instrumentace HPCE v┼żdy obsahuje alespo┼ł jednu
separa─Źn├ş kapil├íru, zdroj nap─Ťt├ş, d├ívkova─Ź vzorku, detektor a za┼Ö├şzen├ş pro
z├íznam analytick├ęho sign├ílu.
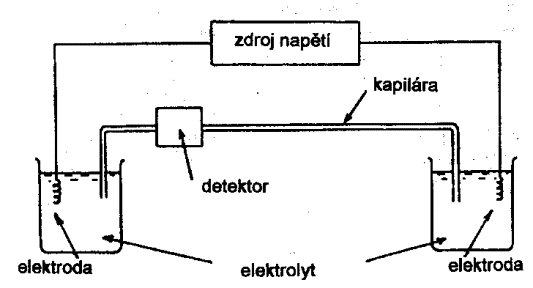
Kapiláry
Kapil├íry jsou obvykle k┼Öemenn├ę pokryt├ę
tenkou vrstvou polyimidu, v├Żjime─Źn─Ť teflonov├ę nebo sklen─Ťn├ę s typick├Żm vnit┼Ön├şm
pr┼»m─Ťrem 50 - 100 ┬Ám, celkov├í d├ęlka b├Żv├í 20 - 100 cm. N├ísledkem p┼»soben├ş
elektrick├ęho pole v kapil├í┼Öe vznik├í tzv. elektroosmotick├Ż tok (EOF), kter├Ż je v
mnoha p┼Ö├şpadech jevem ne┼ż├ídouc├şm, u micel├írn├ş elektrokinetick├ę chromatografie
(MEKC) je naopak podporov├ín, ovliv┼łuje se bu─Ć pota┼żen├şm vnit┼Ön├ş st─Ťny kapil├íry
ochrannou vrstvou nebo vlastnostmi separa─Źn├şho syst├ęmu tj. pH, teplotou,
organick├Żmi modifik├ítory. Trend modifikace kapil├ír pro gelovou kapil├írn├ş
elektrofor├ęzu a isoelektrickou fokusaci sm─Ť┼Öuje k pou┼ż├şv├ín├ş roztok┼» line├írn├şch
polymer┼», kde funk─Źnost kapil├íry lze obnovit prost├Żm promyt├şm roztokem
p┼Ö├şslu┼ín├ęho polymeru.
A. Zdroj nap─Ťt├ş
HPCE vyu┼ż├şv├í zdroj nap─Ťt├ş v
rozsahu 0 - 30 kV a proudu 0 - 300 mA.
B. D├ívkov├ín├ş vzorku
Objem n─Ťkolika nanolitr┼» vzorku
se v HPCE d├ívkuje nej─Źast─Ťji hydrodynamick├Żm tokem nebo elektromigra─Źn─Ť.
C. Detekce
Je v─Ťt┼íinou zaji┼ít─Ťna on-line
sn├şm├ín├şm sign├ílu p┼Ö├şmo v kapil├í┼Öe:
-
UV
detekce je vyu┼ż├şv├ína nej─Źast─Ťji,
-
diode-array
(DAD) je pro identifikaci elektroforetick├Żch p├şk┼» p┼Öi pr├íci s biologick├Żmi
matricemi velmi vhodnou metodou,
-
laserem
indukovan├í fluorescence (LIF) poskytuje vysokou citlivost anal├Żzy (v uk├ízkov├Żch
p┼Ö├şpadech odpov├şd├í detek─Źn├ş limit pouh├Żm 600 molekul├ím),
-
hmotov─Ť
spektrometrick├í detekce (CE-MS), ve spojen├ş s HPCE m├í nejv─Ťt┼í├ş v├Żznam ionizace
elektrosprayem (ESI),
-
amperometrická
detekce rozli┼íuje oxidovateln├ę ionty (nap┼Ö. katecholaminy),
-
konduktometrická
detekce vyu┼ż├şv├í skute─Źnost, ┼że vodivost z├│n analytu se li┼í├ş od vodivosti
pracovn├şho elektrolytu.
5. Aplikace HPCE v klinick├ę chemii
Aplikace kapil├írn├şch elektromigra─Źn├şch technik m├í
nesporn─Ť mnoho v├Żhod. Nejenom vysok├í separa─Źn├ş ├║─Źinnost, selektivita, rychl├í
p┼Öestavitelnost syst├ęmu na jin├Ż separa─Źn├ş re┼żim, ale tak├ę skute─Źnost, ┼że
kombinac├ş dostupn├Żch elektromigra─Źn├şch technik lze rozd─Ťlit t├ęm─Ť┼Ö v┼íechny typy
slou─Źenin p┼Öi minim├íln├ş spot┼Öeb─Ť elektrolyt┼» a extr├ęmn─Ť n├şzk├Żch objemech
vzork┼», otev├şr├í nov├ę perspektivy v biochemii. Je ┼Öada aplikac├ş umo┼ż┼łuj├şc├şch
p┼Ö├şmou anal├Żzu biologick├ęho materi├ílu, ale na druh├ę stran─Ť je nutno ─Źas to
┼Öe┼íit specifick├ę probl├ęmy biologick├Żch matric (nap┼Ö. ┼Ö├ídov├ę rozd├şly v
koncentrac├şch stanovovan├Żch analyt┼», mo┼żn├ę interference apod.). Cesta od
modelov├ę separace standardn├şch sm─Ťs├ş ke stanoven├ş analytu v biologick├ęm
materi├ílu mus├ş tak├ę u HPCE proj├şt d┼»kladn├Żm optimaliza─Źn├şm postupem podm├şnek
vlastn├ş separace, ale i p┼Öedsepara─Źn├şch ├║prav vzorku.
A. Předúpravy vzorků
┬Ě ┼Öed─Ťn├ş (mo─Ź),
┬Ě deproteinace nap┼Ö.
acetonitrilem, etanolem, ultrafiltrac├ş,
┬Ě zakoncentrov├ín├ş a ─Źi┼ít─Ťn├ş
vzorku:
┬á┬á┬á┬á┬á┬á┬á┬á┬á┬á┬á - p┼Ö├şmo
v kapil├í┼Öe vyu┼żit├şm kombinace ITP a CZE,
            -
extrak─Źn─Ť kapalinou (rozpou┼ít─Ťdly, pufry) nebo na pevn├ę f├ízi (C18, ionexy
apod.),
            -
hydrol├Żza.
B. N─Ťkter├ę oblasti aplikac├ş HPCE, p┼Ö├şklady
B.1. Aminokyseliny - thiokarbamylderiváty nebo
derivatizace fenylthiohydantoinem, dansylchloridem, ─Źi monobrombimanem, UV nebo
LIF detekce, doba anal├Żzy 13 - 30 minut.
B.2. L├ęky - monitorov├ín├ş v─Źetn─Ť
metabolit┼», mo┼żnost rozli┼íen├ş optick├Żch izomer┼», ur─Źen├ş vazebn├ę kapacity l├ęku
na proteiny - nej─Źast─Ťji MEKC s pou┼żit├şm SDS, UV detekce, doba anal├Żzy 7 - 15
minut.
B.3. Vitaminy a jejich
metabolity
jako např. B-vitaminy, C-vitamin, kyseliny nikotinová a listová - CZE, UV
detekce.
B.4. Katecholy a katecholaminy - vanilmandlová, homovanilová,
a 5-hydroxyindoloctová kyselina, MEKC, UV detekce.
B.5. Peptidy, proteiny,
glykoproteiny
- mapov├ín├ş peptid┼» (CZE), anal├Żzy s├ęrov├Żch protein┼» (SDS-CGE), separace
hemoglobin┼» (CIEF), cytokiny, transferiny, stanoven├ş enzymov├Żch aktivit
izoenzymů LD.
B.6. Kortikosteroidy - MEKC s SDS v p┼Ö├ştomnosti
mo─Źoviny, UV detekce, 20 minut.
B.7. Organick├ę kyseliny - citr├ít, oxal├ít, lakt├ít,
acet├ít, butyr├ít (ftal├ítov├Ż pufr, UV detekce, doba anal├Żzy 5 minut, nebo mo┼żnost
konduktometrick├ę detekce p┼Öi separa─Źn├şm syst├ęmu morfolinetansulfonov├ę kyseliny
a histidinu).
B.8. Mal├ę ionty - chloridy, bromidy, rodanidy,
fluoridy - MEKC
B.9. Nukleotidy,
oligonukleotidy a nukleov├ę kyseliny (nap┼Ö. sekvence b├íz├ş v molekule DNA, oligothymidylov├ę
kyseliny, ribonukleosidy, cyklick├ę nukleotidy, anal├Żza PCR produkt┼», CGE, MEKC,
LIF nebo UV detekce).
Poznámky
Appendixy
Literatura
Autorsk├ę pozn├ímky
Jaroslava Vávrová