Abstrakt
IgG je jedna ze tříd imunoglobulinů, účastní se všech typů imunních reakcí, aktivuje komplement, jeho Mr je 150 kDa. Sledování hladin IgG má význam hlavně u diagnostiky imunodeficiencí a substituční terapie imunoglobuliny.
Terminologie
Synonyma
Klasifikační kódy
Odkazy na jiné relevantní dokumenty, další informace
Chemická a fyzikální charakteristika, struktura a povaha analytuOSN-E
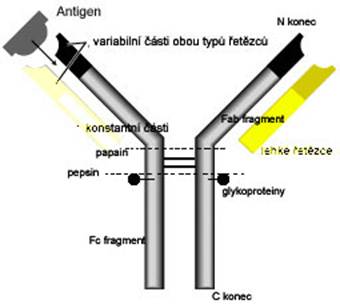
modifikovaný obrázek z webu
Imunoglobuliny v základní struktuře mají dva identické těžké řetězce (H) s molekulovou hmotností 50 kDa a dva lehké řetězce (L) okolo 22 kDa. Řetězce jsou k sobě poutány různým počtem disulfidických vazeb. H a L řezce jsou tvořeny částí variabilní (V) a konstantní (C). Těžké i lehké řetězce mají vedle sebe společně N-terminální konce, skládají se ze série globulárních oblastí z významných homologních aminokyselinových sekvencí (AMK) označovaných jako domény. N-terminální domény
H a L řetězců obsahují variabilní aminokyselinové sekvence (V oblast), které determinují antigenní specifitu. N-terminální AMK ve V oblasti formují funkční region, kam se usadí antigenní epitop. Povrchy vazebných míst a epitopů jsou navzájem komplementární a podle struktury, výběžků, se právě jedině ten správný epitop ze všech naváže na patřičné vazebné místo. Komplementarita není pouze strukturální, ale i chemická a to na podkladě van der Waalsových sil. Jedná se o vodíkové vazby mezi polárními skupinami, o vytvoření iontových vazeb mezi různě nabitými stranami řetězců. Mezi V oblastí a zbývající částí konstantního H řetězce (CH) jsou strukturní a antigenní rozdíly, které imunoglobuliny rozdělují do podtříd. Například u IgG molekul CH domény mají následující funkce: první (CH1) a druhá (CH2) doména formují „skryté místo“, které odpovídá za transformaci z T formy (v roztoku) do V formy při navázání antigenu. CH1 doména se váže na složky komplementu C1q, které vedou k aktivaci klasické cesty kaskády komplementárního systému. Třetí doména (CH3) zprostředkovává vazbu Fc fragmentu na Fc receptor buněk imunitního systému -granulocyty, monocyty, makrofágy. Kombinace CH2 a CH3 společně tvoří další doménu pro vazbu např. granulocytů a NK (natural killers) buněk.
Papain štěpí molekulu imunoglubulinu na tři části, dva identické Fab fragmenty sestávající z kompletních L řetězců (V oblast) a části konstantních H řetězců. Zbývající segment z konstantních oblastí dvou těžkých řetězců spojených disulfidickými můstky je označován jako Fc fragment (c=crystallizable, krystalizující).
Lehké řetězce jsou typu kappa nebo lambda. Každá molekula má dva kappa nebo 2 lambda L řetězce, protože každá B buňka je schopna produkovat pouze jeden typ lehkých řetězců. Lehké řetězce mají N (amino)-terminální, variabilní a C (karboxy) terminální, konstantní konce. L řetězce jsou připojeny k H řetězců prostřednictvím disulfidických můstků, které vytváří cystinové molekuly mezi konstantními oblastmi obou typů řetězců. B lymfocyty produkují průměrně dvakrát více kappa řetězců než lambda. Termín monoklonální lehké řetězce nebo Bence Jones bílkovina je v podstatě důsledek sekrece maligně transformovaných a proliferujících buněk kmene B lymfocytů produkující daný typ L řetězců.
Uvolňování L řetězců z vazby je umožněno sklony cystinových molekul k snadné dimerizaci.
Struktura H řetězce je daná třídou daného imunoglobulinu. Rozdíly mezi imunoglobulinovými skupinami jsou v jejich aminokyselinovém složení, sekvenci, molekulové hmotnosti, v sacharidových zbytcích, antigenitě, alotypové heterogenitě a elektroforetické mobilitě. Je 5 základní skupin těžkých řetězců, každá má dva identické řetězce, IgG skupina má dva γ (gama) těžké řetězce, IgA má α (alfa) řetězce, IgM má µ (mí) řetězce, IgD-δ (delta) řetězce, IgE ε (epsilon) dva těžké řetězce.
J řetězce jsou spojky mezi samotnými molekulami globulinů. Imunoglobuliny třídy IgM a IgA vykazují polymorfismy. IgM molekuly se vyskytující zejména jako pentametry, IgA jako dimer. IgM monomery stejně tak jako IgA monomery jsou spojeny právě prostřednictvím J řetězců. J řetězce jsou glykoproteiny o molekulové hmotnosti 15 kDa a cestou disulfidických vazeb poblíž C terminálních konců spojují mezi sebou těžké řetězce imunoglobulinů.
Sekreční dimery IgA, které jsou produkovány plazmocyty respiračního, urogenitálního a gastrointestinálního traktu a uvolňovány do tělních tekutin s obsahem sekreční komponenty, která chrání imunoglobuliny před štěpícími účinky peptidáz. Sekreční komponenta je glykoprotein s molekulovou hmotností 70 kDa. Dimerické molekuly IgA se nenavážou na sekreční komponenty dokud neprojdou epiteliálním povrchem sliznic, které sekreční komponentu syntetizují. V případě sekreční IgA deficience, je sekreční komponenta stanovitelná.
Antigenní heterogenita se dělí na izotypovou, alotypovou, idiotypovou. Izotypy mají stejné konstantní domény. Izotypové variace mají odlišnosti v H, L řetězcích, doménách, které jsou prezentovány ve všech zdravých jedincích daného druhu. Syntéza izotopů je kódována geny příslušného jedince a druhu. Alotypová variace je definována jako alelou indukovaná variace imunoglobulinu uvnitř druhu. Alotypy se objevují jako variace konstantní části H řetězce. Alotypové variace jsou často důsledek AMK výměn uvnitř H řetězce. Idiotypy mají stejné variabilní domény. Idiotypové variace souvisí s rozmanitostí v antigenních vazebných místech. Imunoglobuliny syntetizované jedním klonem plazmatických buněk jsou normálně kompletně identické, vytváří uniformní idiotyp. Alterace, změny AMK ve V oblasti vytváří idiotypové variace. Stejně tak antigeny můžeme dělit na stejné izotypy nebo alotypy. V případě paraproteinů se jedná pravděpodobně o idiotypovou variaci.
Role v metabolismu
IgM zajišťují ochranu organismu u primárních (primární protilátkou zprostředkovaná odpověď) infekcí. IgG jsou sekundární protilátkou u infekcí, které již organismus prodělal (sekundární protilátková odpověď). Zhruba polovina všech IgG je v plazmě, druhá polovina je v tělesných tekutinách. Při elektroforetickém dělení bílkovin séra IgG jsou lokalizovány v gama frakci. Za normálních okolností IgG2 a IgG4 migrují společně k anodě a IgG1 a 3 ke katodické části gama frakce. Fetální IgG z mateřské krve během prvních 20 gestačních týdnů plodu odpovídá zhruba 10% koncentrace Ig (imunoglobulinu) dospělých jedinců. Fetální infekce během této periody nevedou ke zvýšení hladiny Ig. Mezi 22. a 28. gestačním týdnem věku plodu dochází k výraznému zvýšení placentární permeability, Ig z mateřské krve přechází do plodu a hladina Ig plodu se vyrovnává hladině Ig matky. Koncentrace IgG1,3,4 jsou stejné u plodu jako matky zatímco IG2 je nižší. Po obdržení maternálních imunoglobulinů se zvyšuje cirkulace v plodu s poločasem 30 dní. Tato koncentrace přetrvává až do 3 až 4 měsíce po porodu (3,5-4 g/l). Než syntézu Ig zcela samostatně převezme novorozený organismus překrývají se hladiny mateřského a vlastního Ig, kdy koncentrace celkového Ig u novorozence na konci 1. roku je 7 až 8 g/l. Syntéza IgG je závislá na vyzrávání imunitního systému, vytváření antigenní odpovědi po přirozené expozici antigenům. Jedná se o proteinové antigeny (v bakteriích, virech) vedoucí k IgG1,3 syntéze a indukované CD4+ buňkami, sacharidové antigeny (enkapsulované bakterie jako pneumokokové kmeny, streptokoky skupiny A, H, influenza viry) reagující zmnožením IgG2 a částečně IgG1 a neindukované CD4+ buňkami. Na organismus působí i expozice polyvalentními antigeny charakteru parazitů, hmyzu, hadích jedů, potravinových alergenů, které působí jako chronická antigenní stimulace na produkci IgG4. IgG4 protilátky stejně jako IgE se váží na povrchové receptory mastocytů a stimulují tvorbu IgG1 a 3 tvorbu autoprotilátek.
Zdroj (syntéza, příjem)
V séru zdravých jedinců se nachází všechny třídy imunoglobulinů: IgG, IgA, IgM, IgD, IgE ve fyziologické koncentraci. IgG má 4 podtřídy, u IgA a IgM jsou známy dvě podtřídy.
Distribuce v organismu, obsah ve tkáních
IgG se vyskytuje ve 4 třídách. IgG1 je zastoupeno v 60-75%, IgG2 v 15-25%, IgG3 v 3-6%, IgG4 v 2-6%. Produkce specifických protilátek jednotlivých tříd je závislá na stimulujícím antigenu. Analyticky se dají stanovovat všechny podtřídy IgG.
Způsob vylučování nebo metabolismus
Produkce IgG v jednotlivých podtřídách je regulována interleukiny a částečně určována i počtem B buněčných subpopulací v tkáních. Například u zdravých jedinců je dominantní podtřídou IgG 1 a 2 v plazmě, v tonzilách dominují cytoplazmatické buňky s produkcí IgG1 a 3. Ve struktuře IgG má velký význam Fc fragment, který umožňuje vazbu na Fc receptory buněk imunitního systému. Odpovídá za vychytávání bakterií makrofágy, které jsou atakovány IgG molekulami, kdy Fc fragment IgG se naváže na Fc receptor makrofágů a navázané bakterie na Ig jsou obalovány a nakonec inkorporovány do makrofágů k destrukci. Mezi buňky s Fc receptory patří i monocyty, granulocyty, lymfocyty. Katabolismus IgG závisí na jeho plazmatické hladině. Při vyšších hodnotách IgG je clearance zrychlena až na poločas 11 dní, při nízké syntéze IgG je poločas prodloužen i na 30 dní.
Biologický poločas
7-21 dní
Kontrolní (řídící) mechanismy
Literatura
Lothar Thomas, Clinical Laboratory Diagnostics, 1st. English Edition, TH-Books, Germany 1998
Poznámky
IgD má Mr 175 kDa.
Appendixy
Autorské poznámky
Jiřina Lukášková (2008)